PLoS One, 06/05/2025
Giới thiệu
Viêm là phản ứng bảo vệ thiết yếu của cơ thể nhằm chống lại tác nhân gây nhiễm trùng và tổn thương mô. Tuy nhiên, phản ứng viêm cũng liên quan đến nhiều tình trạng bệnh lý khác nhau, bao gồm suy tim, thoái hóa khớp, viêm khớp dạng thấp, bệnh viêm ruột, đái tháo đường, tổn thương phổi cấp, tổn thương thận cấp và xơ hóa mô. Ngoài ra, viêm còn được cho là góp phần gây mệt mỏi và liên quan mật thiết đến gây cảm giác đau. Do vai trò trung tâm của viêm trong các bệnh lý này, các liệu pháp kháng viêm đã được nghiên cứu như hướng điều trị tiềm năng cho nhiều tình trạng bệnh khác nhau.
Tế bào gốc trung mô (MSCs) là loại tế bào gốc trưởng thành phong phú, có tác dụng điều hòa miễn dịch và kháng viêm mạnh. MSCs hoạt động thông qua:
- Tiết cytokine kháng viêm (IL-10, TGF-β, IL-1RA).
- Điều biến hoạt tính của tế bào miễn dịch → giúp cân bằng đáp ứng viêm.
MSCs đã được nghiên cứu trong mô hình tiền lâm sàng và lâm sàng cho các bệnh liên quan đến viêm. Nguồn tế bào gốc trung mô có thể đến từ:
- AD-MSCs (mô mỡ):
- Hiệu quả trong bệnh tim và phổi.
- Giảm viêm cơ tim, thúc đẩy tái tạo mô.
- Điều hòa đại thực bào và tế bào T → hỗ trợ điều trị ARDS.
- UC-MSCs (dây rốn):
- Tăng cường tái tạo mô thận qua tác dụng cận tiết.
- Có khả năng điều hòa miễn dịch và kháng viêm mạnh hơn AD-MSCs, phù hợp cho liệu pháp tái tạo thận.
Nhiều tác dụng điều trị của tế bào gốc trung mô (MSCs) được cho là do các yếu tố tiết ra chứ không phải chính tế bào, do đó dịch nuôi cấy có điều kiện từ MSC (MSC-CM) đã nổi lên như một liệu pháp thay thế tiềm năng. So với việc cấy ghép trực tiếp MSCs, liệu pháp MSC-CM mang lại nhiều ưu điểm, trong đó nổi bật là giảm nguy cơ thải ghép miễn dịch, vì MSC-CM không chứa tế bào sống, giúp hạn chế phản ứng viêm và loại bỏ nguy cơ đào thải miễn dịch. Bên cạnh đó, MSC-CM cũng được đánh giá là an toàn hơn về mặt ung thư học, do trong khi MSCs (nội sinh hoặc ngoại sinh) có thể thúc đẩy tăng sinh tế bào u trong một số điều kiện nhất định, MSC-CM lại cho thấy tác dụng ức chế khối u thông qua việc ức chế các tín hiệu sinh ung, củng cố tính an toàn tiềm năng ở bệnh nhân có nguy cơ ung thư.
Tuy nhiên, MSC-CM chứa cả các yếu tố tiết từ tế bào và thành phần của môi trường nuôi cấy, nên các yếu tố này có thể ảnh hưởng đến tính an toàn và hiệu quả điều trị. Trước đây, MSC thường được nuôi trong môi trường chứa huyết thanh bào thai bò (FBS), khiến MSC-CM có thể chứa thành phần có nguồn gốc động vật và tiềm ẩn nguy cơ lây nhiễm virus. Ngoài ra, dù đã có một số báo cáo lâm sàng về việc sử dụng MSC-CM trong các bệnh lý khác nhau, hiệu quả và độ an toàn vẫn được cho là phụ thuộc vào nguồn nguyên liệu và quy trình sản xuất, do đó chưa thể khái quát kết quả cho ứng dụng trên người.
Để giải quyết những lo ngại nêu trên, nhóm nghiên cứu đã giảm thiểu nguy cơ nhiễm khuẩn cho bệnh nhân được điều trị bằng cách thu nhận mô mỡ hoặc dây rốn từ các người hiến khỏe mạnh, không mắc bệnh truyền nhiễm, và nuôi cấy trong môi trường không có thành phần có nguồn gốc động vật. Sau đó, nhóm lựa chọn dịch nuôi cấy MSC (MSC-CM) đã trải qua kiểm soát chất lượng nghiêm ngặt, bao gồm kiểm tra an toàn virus đối với sản phẩm hoàn chỉnh. Bên cạnh đó, nghiên cứu cũng tổng hợp và đánh giá tính an toàn của việc sử dụng MSC-CM với liều tương đối lớn qua nhiều đường dùng khác nhau trong bốn nghiên cứu quan sát độc lập.
Vật liệu và phương pháp
Các vấn đề đạo đức
Bác sĩ điều trị đã giải thích đầy đủ nội dung nghiên cứu cho người tham gia thông qua tài liệu đồng thuận tham gia nghiên cứu và thu nhận phiếu tự nguyện đồng ý tham gia nghiên cứu trước khi tiến hành thử nghiệm điều trị.
Người tham gia
Nhóm tham gia nghiên cứu bao gồm những bệnh nhân không đạt hiệu quả mong muốn với các phương pháp điều trị tiêu chuẩn, những người từ chối sử dụng thuốc thông thường do lo ngại tác dụng phụ hoặc các yếu tố bất lợi khác, và những trường hợp được bác sĩ chỉ định rằng phù hợp điều trị bằng MSC-CM.
- Tiêu chí chọn mẫu:
Bao gồm các bệnh nhân từ 18 tuổi trở lên, có sự đồng thuận tham gia nghiên cứu, hiểu rõ nội dung điều trị thông qua tài liệu giải thích, và tự nguyện ký văn bản đồng ý sau khi được tư vấn đầy đủ. Chỉ những bệnh nhân được bác sĩ điều trị đánh giá là cần thiết và phù hợp để điều trị mới được đưa vào nghiên cứu.
- Tiêu chí loại trừ:
Loại khỏi nghiên cứu đối với các trường hợp có tiền sử hoặc nghi ngờ sa sút trí tuệ, sử dụng ma túy hoặc chất kích thích, đang mang thai hoặc cho con bú, hoặc được bác sĩ điều trị đánh giá là không thích hợp tham gia.
- Tiêu chí chọn bổ sung theo bệnh lý:
- Bệnh nhân chỉ mắc bệnh phổi, bao gồm viêm tiểu phế quản lan tỏa, bệnh phổi kẽ, hoặc bệnh phổi tắc nghẽn mạn tính (COPD);
- Bệnh nhân khó thở do bệnh phổi và được bác sĩ xác định là phù hợp để điều trị;
- Bệnh nhân chỉ mắc bệnh tim, có nồng độ NT-proBNP huyết thanh ≥ 900 pg/mL;
- Bệnh nhân suy thận mạn đơn thuần, với mức lọc cầu thận ước tính (eGFR) ≤ 40 mL/phút/1,73 m².
Chuẩn bị MSC-CM
Dịch nuôi cấy có điều kiện từ tế bào gốc trung mô người thu từ mô mỡ (AD-MSC-CM) và từ dây rốn (UC-MSC-CM) được sản xuất trong môi trường không chứa thành phần có nguồn gốc động vật. Mẫu mô cho AD-MSC-CM và UC-MSC-CM lần lượt được thu nhận từ hai phụ nữ Nhật Bản ở độ tuổi 20, đã có kết quả xét nghiệm âm tính với virus và đồng ý hiến mẫu thông qua văn bản đồng thuận.
Từ các mẫu này, tế bào gốc trung mô (AD-MSCs và UC-MSCs) được phân lập, và phần phân đoạn mạch đệm (stromal fraction) được nuôi cấy trong môi trường không huyết thanh MS-E0001 (BioMimetics Sympathies, Inc., Tokyo, Nhật Bản) ở 37 °C trong điều kiện 5% CO₂. Sau đó, 1,2–1,8 × 10⁶ tế bào MSC ở thế hệ 4–5 được nuôi cấy trong 28–35 mL môi trường MS-E0001. Khi độ phủ tế bào đạt 90%, môi trường được thay mới bằng môi trường MS-E0006 (BioMimetics Sympathies, Inc.) và ủ thêm 2 ngày.
Dịch nuôi cấy (MSC-CM) sau đó được thu thập và lọc qua màng lọc 0,22 µm. Trong quá trình sản xuất, thực hiện kiểm tra không nhiễm virus, và sản phẩm cuối cùng vượt qua các kiểm tra về nội độc tố, vô khuẩn, mycoplasma và màu sắc. Ngoài ra, kiểm tra trực quan để phát hiện tạp nhiễm vật chất ngoại lai cũng được tiến hành, và không ghi nhận bất thường. Cuối cùng, MSC-CM được chia ra và bảo quản ở –30 °C cho đến khi sử dụng. Cả AD-MSC-CM và UC-MSC-CM sử dụng trong nghiên cứu này đều được tạo lập từ cùng một người hiến tương ứng (mỗi loại MSC-CM đến từ một người hiến duy nhất).
Xét nghiệm miễn dịch hấp phụ liên kết enzyme (ELISA)
Đo nồng độ HGF và exosome trong dịch nuôi cấy (CM) bằng phương pháp ELISA theo hướng dẫn của nhà sản xuất.
- HGF: đánh giá khả năng thúc đẩy tăng sinh, di chuyển, biệt hóa tế bào → phản ánh hiệu quả điều trị tái tạo.
- Exosome: đánh giá vai trò trong truyền tín hiệu và phục hồi tế bào.
Thử nghiệm trên tế bào nội mô tĩnh mạch rốn người (HUVECs)
Thí nghiệm trên tế bào nội mô tĩnh mạch rốn người (HUVECs) nhằm đánh giá tác dụng chống viêm của AD-MSC-CM và UC-MSC-CM. Mục tiêu là kiểm tra xem MSC-CM có khả năng làm giảm phản ứng viêm do TNF-α gây ra trên tế bào nội mô hay không.
Tế bào HUVECs được nuôi trong môi trường DMEM/F12 có bổ sung 10% huyết thanh bào thai bò (FBS), 10 ng/mL yếu tố tăng trưởng nguyên bào sợi cơ bản (b-FGF) và 10 μg/mL gentamicin, ở 37 °C trong điều kiện 5% CO₂. Khi tế bào đạt đến mật độ phù hợp, quá trình gây viêm được thực hiện bằng cách bổ sung 10 ng/mL TNF-α vào môi trường nuôi. Đồng thời, các nhóm thử nghiệm được xử lý với môi trường nuôi đối chứng (MS-E0006), môi trường nuôi cấy có điều kiện từ tế bào gốc trung mô mô mỡ người (AD-MSC-CM) hoặc từ dây rốn người (UC-MSC-CM) ở nồng độ cuối 75%. Tế bào được ủ trong 3 ngày, sau đó được ly giải để tách chiết RNA, thực hiện phiên mã ngược thành cDNA. Dùng real-time PCR nhằm xác định mức biểu hiện của các gen IL-6 và IL-8 là hai marker viêm đặc trưng. Gen GAPDH được sử dụng làm gen nội chuẩn để hiệu chỉnh dữ liệu biểu hiện gen.
Phác đồ sử dụng
Trước khi bắt đầu điều trị, bệnh nhân được phỏng vấn khoảng 1 tuần trước lần truyền đầu tiên. Đối với đường truyền động mạch (IA) và đường tĩnh mạch (IV), dịch môi trường có điều kiện (CM) được truyền 3 lần mỗi tháng. Trong khi đó, đối với đường hít (INH), CM được sử dụng 1 lần mỗi tuần, tổng cộng 12 lần điều trị.
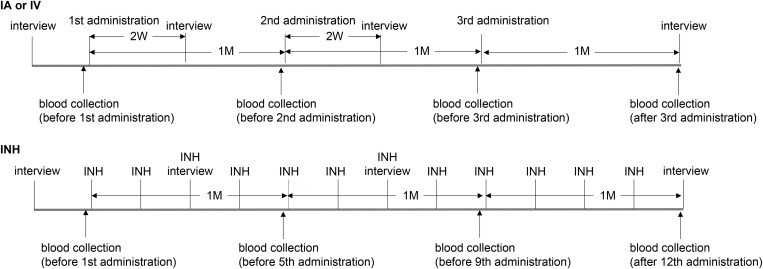
Phần trên của hình: Lịch trình điều trị bằng đường động mạch (IA) hoặc tĩnh mạch (IV) của các bệnh nhân tham gia. Bệnh nhân được phỏng vấn khoảng 1 tuần trước lần truyền đầu tiên, sau đó CM được truyền 3 lần mỗi tháng. Mẫu máu được thu thập ngay trước mỗi lần truyền và 1 tháng sau lần truyền thứ ba, sau đó lưu trữ huyết thanh.
Các buổi phỏng vấn chủ quan về thay đổi triệu chứng được tiến hành 2 tuần sau lần truyền thứ nhất và thứ hai, cũng như 1 tháng sau lần truyền thứ ba.
Phần dưới của hình: Lịch trình điều trị bằng đường hít (INH) của các đối tượng tham gia. Bệnh nhân được phỏng vấn khoảng 1 tuần trước lần sử dụng đầu tiên, sau đó thực hiện tổng cộng 12 lần điều trị, mỗi tuần 1 lần. Mẫu máu được lấy ngay trước các lần điều trị thứ nhất, thứ năm, và thứ chín, cũng như 1 tuần sau lần điều trị thứ 12, sau đó lưu trữ huyết thanh. Các buổi phỏng vấn được tiến hành trước lần điều trị thứ ba, thứ bảy, và 1 tuần sau lần điều trị thứ 12.
Phương pháp sử dụng chế phẩm
- Nguyên tắc chung
Trong các bệnh có cơ quan tổn thương rõ (tim, phổi, thận), CM được truyền với lượng lớn (≈30 mL) trong 24 giờ qua đường động mạch để tập trung hiệu quả tại vùng bệnh.
Đối với điều trị tình trạng mệt mỏi (mạn tính), CM được truyền tĩnh mạch (≈10 mL) để phân bố toàn thân, giảm chi phí và đảm bảo an toàn bằng cách truyền chậm trong 3 giờ.
- Bệnh phổi và suy tim
Đối với bệnh nhân mắc bệnh phổi hoặc suy tim, 30 mL dịch nuôi cấy từ tế bào gốc trung mô từ mô mỡ người (AD-MSC-CM) được pha với 500 mL dung dịch nước muối sinh lý. Hỗn hợp này được truyền vào động mạch phổi thông qua tĩnh mạch giữa khuỷu tay, sử dụng ống thông Swan-Ganz trong vòng 24 giờ.
Nếu sau đợt truyền đầu tiên không ghi nhận cải thiện về triệu chứng lâm sàng chủ quan, bệnh nhân sẽ được truyền UC-MSC-CM (dịch nuôi cấy từ tế bào gốc trung mô dây rốn người) trong lần kế tiếp. Trong những trường hợp khó đặt ống thông, CM được truyền tĩnh mạch trong 3 giờ.
- Bệnh thận mạn tính
Đối với bệnh nhân suy thận mạn, 30 mL dịch nuôi cấy từ tế bào gốc trung mô dây rốn người (UC-MSC-CM) được pha với 500 mL dung dịch muối sinh lý. Hỗn hợp này được truyền qua ống thông Good Tech HT đặt tại tĩnh mạch giữa khuỷu tay, dẫn vào động mạch chủ xuống, cách chỗ chia nhánh của động mạch thận khoảng 2 cm, và được truyền liên tục trong khoảng 24 giờ.
- Mệt mỏi toàn thân
Đối với bệnh nhân bị mệt mỏi toàn thân, 10 mL dịch nuôi cấy từ tế bào gốc trung mô mô mỡ người (AD-MSC-CM) được pha với 500 mL dung dịch nước muối sinh lý và truyền qua tĩnh mạch giữa khuỷu tay trong khoảng 3 giờ. Nếu không có cải thiện rõ rệt về triệu chứng chủ quan, bệnh nhân sẽ được chuyển sang sử dụng UC-MSC-CM trong lần truyền tiếp theo.
Trong trường hợp không thể truyền tĩnh mạch, bệnh nhân được hít khí dung (INH) bằng hỗn hợp gồm 1 mL AD-MSC-CM và 4 mL dung dịch nước muối sinh lý, sử dụng máy xông khí dung. Liệu pháp hít được thực hiện một lần mỗi tuần, tổng cộng 12 lần.
Phỏng vấn bệnh nhân
Trước khi tiến hành truyền, bác sĩ điều trị trao đổi với bệnh nhân về triệu chứng hiện tại và tiền sử bệnh lý.
Đối với đường truyền động mạch (IA) và đường truyền tĩnh mạch (IV), các cuộc phỏng vấn được thực hiện sau 2 tuần kể từ lần truyền thứ nhất và thứ hai, cũng như 1 tháng sau lần truyền thứ ba, nhằm đánh giá triệu chứng chủ quan và các tác dụng không mong muốn.
Đối với đường hít khí dung (INH), bác sĩ phỏng vấn bệnh nhân vào các ngày tiến hành lần hít thứ 3 và thứ 7, cùng với 1 tuần sau lần hít thứ 12 (cuối cùng) để theo dõi tình trạng và phản ứng điều trị.
Xét nghiệm máu
Mẫu huyết thanh được thu thập trước mỗi lần truyền và 1 tháng sau lần truyền thứ ba (đối với đường hít INH: lấy trước các lần thứ nhất, thứ năm, thứ chín và 1 tuần sau lần thứ 12). Các xét nghiệm cần thiết được thực hiện tùy theo loại bệnh của từng bệnh nhân. Mặc dù tế bào gốc trung mô (MSCs) có tác dụng điều hòa miễn dịch, song việc truyền dịch môi trường nuôi cấy MSC (MSC-CM) có thể gây phản ứng viêm hoặc dị ứng ngoài ý muốn. Vì vậy, việc theo dõi chỉ số viêm của bệnh nhân trong suốt quá trình điều trị là rất quan trọng.
Để đánh giá tình trạng viêm, nhóm nghiên cứu định lượng nồng độ protein phản ứng C (CRP) trong huyết thanh trước và sau khi truyền MSC-CM. CRP là một protein được gan sản xuất nhanh chóng để đáp ứng với tình trạng viêm trong cơ thể. Các hạng mục xét nghiệm được quy định riêng cho từng nghiên cứu tùy bệnh lý, nhưng CRP là chỉ số chung được kiểm tra cho tất cả bệnh nhân.
Phân tích thống kê
Dữ liệu CRP được kiểm tra bằng Kolmogorov–Smirnov và phân tích bằng kiểm định Wilcoxon do không phân bố chuẩn; các phân tích được thực hiện trên R 4.4.1 với ngưỡng giá trị p < 0,05.
Kết quả
Phân tích đặc tính của AD-MSC-CM và UC-MSC-CM
Để so sánh đặc tính giữa dịch nuôi cấy tế bào gốc trung mô nguồn gốc từ mô mỡ (AD-MSC-CM) và từ dây rốn (UC-MSC-CM), nhóm nghiên cứu định lượng yếu tố tăng trưởng tế bào gan (HGF) và số lượng exosome bằng phương pháp ELISA. Kết quả cho thấy không có sự khác biệt đáng kể về nồng độ HGF cũng như lượng exosome giữa hai loại dịch nuôi cấy này.
Tiếp theo, nhóm nghiên cứu đánh giá tác dụng kháng viêm của MSC-CM trên tế bào nội mô tĩnh mạch rốn người (HUVECs). Kết quả cho thấy, việc sử dụng AD-MSC-CM và UC-MSC-CM đều ức chế sự tăng biểu hiện mRNA của IL-6 và IL-8 do TNF-α gây ra. Điều này cho thấy cả hai loại MSC-CM đều có hoạt tính kháng viêm rõ rệt.
Thử nghiệm an toàn
Tổng cộng có 55 người tham gia nghiên cứu (31 nam, 24 nữ; tuổi trung bình 77,4 ± 10,1). Phân bố đối tượng theo bệnh lý như sau: bệnh phổi (12 người; 7 nam, 5 nữ), suy tim (14 người; 7 nam, 7 nữ), suy thận mạn (10 người; 7 nam, 3 nữ) và mệt mỏi toàn thân (19 người; 10 nam, 9 nữ). Trong đó, 54 người được truyền tĩnh mạch 3 lần, và 1 người được điều trị bằng khí dung (INH) 12 lần, tổng cộng 174 lần dùng MSC-CM (Bảng 2).
Một số tác dụng bất lợi nhẹ được ghi nhận, bao gồm:
- Chóng mặt trong khi xoa bóp (mã SK003, sau lần truyền đầu tiên; CTCAE v5.0 code 1001375, độ 1),
- Chán ăn (SK004, sau lần truyền thứ hai; CTCAE code 10002646, độ 1),
- Viêm ruột – đại tràng (SH008, sau lần truyền thứ ba; CTCAE code 10014893, độ 1),
- Thận ứ nước sau thận (SH008, sau lần truyền thứ ba; CTCAE code 10038369, độ 2),
- Sốt 40 °C (SH009, sau lần truyền đầu tiên; CTCAE code 10016558, độ 2).
Không ghi nhận bất kỳ biến cố bất lợi nghiêm trọng nào như tử vong, đe dọa tính mạng, tàn tật đáng kể, tổn thương vĩnh viễn hay cần can thiệp y tế khẩn cấp trong suốt 174 lần dùng. Trong tổng số 55 bệnh nhân, 4 người gặp phản ứng nhẹ có nguyên nhân chưa xác định rõ ràng liên quan đến việc sử dụng MSC-CM.
Thay đổi các chỉ dấu viêm
Không có sự khác biệt có ý nghĩa thống kê về nồng độ CRP huyết thanh trước và sau khi truyền cả AD-MSC-CM và UC-MSC-CM (p = 0.5994, n = 55). Tuy CRP giảm nhẹ sau truyền, kết quả này gợi ý rằng việc sử dụng MSC-CM không gây ra phản ứng viêm đáng kể ở người tham gia.
Các nhà nghiên cứu so sánh sự thay đổi nồng độ CRP trước và sau khi truyền MSC-CM theo từng đường dùng. Kết quả cho thấy CRP có xu hướng giảm ở tất cả các đường dùng (IA, IV, INH), mặc dù không có sự khác biệt có ý nghĩa thống kê. Đáng chú ý, bệnh nhân duy nhất được điều trị bằng đường hít (INH) có mức giảm CRP rõ hơn. Một trường hợp ngoại lệ là bệnh nhân SH008, người xuất hiện viêm ruột kết không rõ nguyên nhân sau lần truyền thứ ba, sau đó được chẩn đoán ứ nước thận sau. Mối liên hệ giữa sự việc này và việc truyền MSC-CM vẫn chưa được xác định.
Do giá trị CRP trước điều trị dao động mạnh, các mẫu được chia thành 2 nhóm:
- CRP > 0.3 mg/dL (có viêm): CRP giảm đáng kể sau truyền (1.109 → 0.413 mg/dL, p = 0.0122) → gợi ý MSC-CM có tác dụng kháng viêm ở người có tình trạng viêm cao.
- CRP < 0.3 mg/dL (bình thường): CRP tăng nhẹ nhưng vẫn dưới ngưỡng bình thường (0.069 → 0.098 mg/dL, p = 0.0415) → không gây phản ứng viêm mới.
MSC-CM có thể giúp giảm viêm ở bệnh nhân có tình trạng viêm sẵn có, và an toàn ở người có chỉ số viêm bình thường.
Thảo luận
Mục tiêu chính của nghiên cứu này là đánh giá độ an toàn của phác đồ truyền nhiều lần dịch nuôi cấy có điều kiện từ tế bào gốc trung mô (MSC-CM) với thể tích lớn (10 hoặc 30 mL). Kết quả cho thấy không có khác biệt đáng kể về thành phần hoặc tác dụng giữa dịch nuôi cấy có điều kiện từ tế bào gốc mô mỡ (AD-MSC-CM) và tế bào gốc dây rốn (UC-MSC-CM), nên chưa thể xác định loại nào phù hợp hơn cho từng bệnh cụ thể.
Trong tổng số 162 lần truyền tĩnh mạch cho 54 bệnh nhân và 12 lần hít cho 1 bệnh nhân, không ghi nhận biến cố nghiêm trọng nào. Điều này cho thấy các thành phần của MSC-CM có thể không gây kích hoạt miễn dịch quá mức, giúp duy trì tính an toàn khi sử dụng nhiều lần.
Bốn bệnh nhân trong nghiên cứu xuất hiện các tác dụng phụ nhẹ, bao gồm chán ăn, chóng mặt và sốt thoáng qua. Hai bệnh nhân suy thận mạn được truyền UC-MSC-CM qua động mạch chủ bị chán ăn và chóng mặt, trong khi một bệnh nhân suy tim được truyền AD-MSC-CM qua động mạch phổi xuất hiện sốt tạm thời. Các triệu chứng này chỉ xảy ra một lần trong ba lần truyền, tự khỏi trong vòng 1–2 ngày mà không cần can thiệp y tế. Ngoài ra, mức CRP của các bệnh nhân này hoặc giảm, hoặc dao động trong giới hạn bình thường (<0,3 mg/dL), cho thấy khả năng MSC-CM không phải nguyên nhân trực tiếp gây ra các phản ứng này.
Một bệnh nhân khác (SH008) có mức CRP ban đầu cao hơn 0,3 mg/dL ghi nhận sự tăng CRP sau khi truyền AD-MSC-CM qua động mạch phổi. Hai ngày sau lần truyền thứ ba, bệnh nhân được chẩn đoán viêm đại tràng không rõ nguyên nhân, sau đó là ứ nước thận sau, nhưng các biểu hiện này khó có khả năng liên quan trực tiếp đến đường truyền hoặc MSC-CM. Dù kết quả chung cho thấy liệu pháp MSC-CM an toàn và dung nạp tốt khi sử dụng nhiều lần, vẫn cần có thêm nghiên cứu với số lượng mẫu lớn hơn để khẳng định chắc chắn về tính an toàn lâu dài và cơ chế tác động tiềm ẩn.
Nghiên cứu này đánh giá tính an toàn của việc truyền toàn thân dịch nuôi cấy từ tế bào gốc trung mô (MSC-CM) bằng cách theo dõi biến động CRP huyết thanh. Kết quả cho thấy CRP trung bình giảm ở toàn bộ 55 bệnh nhân, đặc biệt ở nhóm có CRP ≥ 0,3 mg/dL thì giảm có ý nghĩa thống kê, gợi ý rằng MSC-CM có thể giúp ức chế phản ứng viêm toàn thân. Ở nhóm có CRP < 0,3 mg/dL, mức CRP tăng nhẹ nhưng vẫn trong giới hạn bình thường, không có ý nghĩa lâm sàng.
Các tác dụng phụ ghi nhận đều nhẹ, thoáng qua và tự hồi phục, không có biến cố nghiêm trọng nào xảy ra trong 174 lần truyền, cho thấy liệu pháp MSC-CM an toàn, kể cả ở người cao tuổi (tuổi trung bình 76,2 ± 11,1). Kết quả này khẳng định tính dung nạp và tiềm năng ứng dụng của MSC-CM trong điều trị các bệnh mạn tính, đồng thời mở ra triển vọng phát triển các liệu pháp sinh học an toàn hơn.
Đáng chú ý, đây là một trong số ít nghiên cứu ghi nhận việc truyền nhiều lần MSC-CM với thể tích lớn (10–30 mL) qua đường động mạch, tĩnh mạch hoặc hít, mà vẫn đảm bảo an toàn. Không có khác biệt rõ về giảm CRP giữa các đường truyền, cho thấy truyền tĩnh mạch hoặc hít có thể được sử dụng phổ biến hơn. Tuy nhiên, do số ca còn hạn chế, đặc biệt với đường hít, các nghiên cứu tiếp theo cần mở rộng mẫu và đánh giá thêm các chỉ số khác như Galectin-3, NT-proBNP hoặc eGFR để khẳng định hiệu quả điều trị toàn diện hơn.
Kết luận
Nghiên cứu này khẳng định tính an toàn của việc truyền nhiều lần dịch nuôi cấy có điều kiện từ tế bào gốc trung mô (MSC-CM) được sản xuất bằng công nghệ không có nguồn gốc từ động vật trên 55 bệnh nhân mắc bệnh mạn tính không đáp ứng với điều trị thông thường. Không ghi nhận biến cố bất lợi nghiêm trọng, và các phản ứng phụ nhẹ chỉ xuất hiện ở một vài trường hợp.
Sự thay đổi nồng độ CRP huyết thanh cho thấy việc truyền toàn thân MSC-CM không gây ra phản ứng viêm, chứng minh rằng liệu pháp này dung nạp tốt và an toàn. Những kết quả này gợi ý rằng MSC-CM, khi được sản xuất và sử dụng đúng cách, có thể là một lựa chọn điều trị tiềm năng cho các bệnh mạn tính, mở ra hướng tiếp cận mới cho bác sĩ và bệnh nhân. Tuy nhiên, các nghiên cứu mở rộng vẫn cần được thực hiện để đánh giá đầy đủ hiệu quả điều trị và cơ chế tác động của MSC-CM.
Tài liệu tham khảo
Bài viết được dịch và tóm tắt từ bài báo (nếu có): Inami N. (2025). Safety assessment of multiple systemic administration of human mesenchymal stem cell-conditioned medium for various chronic diseases. PLoS One. May 6;20(5): e0322497.
Nguồn: PLoS One