The Scientist, 14/05/2025
Giống như ung thư, tế bào nhau thai nhân lên nhanh chóng, xâm lấn mô và trốn tránh sự phá hủy bởi hệ miễn dịch – nhưng bằng cách nào đó, cơ thể người mẹ vẫn kiểm soát được chúng.
Sau nhiều thế kỷ đầy mơ hồ, vào đầu thế kỷ 20, các nhà nghiên cứu cuối cùng đã bắt đầu hiểu được ung thư là gì và bắt nguồn từ đâu. Họ xác định chính xác một số hóa chất và virus góp phần gây bệnh. Tuy nhiên, vẫn tồn tại những giả thuyết chưa hoàn toàn đúng: Chẳng hạn, nhà sinh học tiến hóa John Beard cho rằng tế bào ung thư thực chất là nguyên bào nuôi dưỡng (trophoblast) – những tế bào tạo nên lớp ngoài của phôi sớm và sau đó phát triển thành nhau thai – chỉ đơn giản là chúng đã kết thúc sai vị trí, tức là thay vì phát triển ở nhau thai, chúng chui vào mô thai nhi và gây ra vấn đề về sau.1
Mặc dù giờ ta biết rằng ung thư không bắt nguồn từ trophoblast, nhưng lý thuyết của Beard đã mở ra mối liên hệ thú vị giữa sinh học nhau thai và ung thư. “Các tế bào nhau thai xâm nhập vào cơ thể người mẹ,” nhà sinh học tế bào Kshitiz (Đại học Connecticut) cho biết. “Chúng sử dụng rất nhiều cơ chế giống ung thư – thậm chí đôi khi còn sáng tạo hơn.”
Những điểm tương đồng giữa tế bào nhau thai và tế bào ung thư. Các tế bào nhau thai trải qua giai đoạn tăng sinh mạnh mẽ, được hỗ trợ bởi sự tăng biểu hiện của các yếu tố tăng trưởng và con đường tín hiệu chống chết theo chương trình (anti-apoptotic pathway).2 Giống tế bào ung thư, tế bào nhau thai tiết ra yếu tố tiền tạo mạch (pro-angiogenic factors) để thúc đẩy sự phát triển các mạch máu nhằm lấy oxy và dinh dưỡng.3 Năm 2021, các nhà nghiên cứu tại Đại học Cambridge đã giải trình tự mô nhau thai và ngạc nhiên trước mức độ và sự đa dạng của đột biến gen, trong đó có nhiều dấu hiệu giống với u nguyên bào thần kinh (neuroblastoma) hoặc u cơ vân (rhabdomyosarcoma). 4
“Ung thư trốn tránh hệ miễn dịch bằng cách che giấu hoặc làm suy yếu phản ứng miễn dịch để tồn tại. Nếu không, chúng sẽ bị loại bỏ rất dễ dàng.” – Kshitiz giải thích. Tương tự như tế bào ung thư, tế bào nhau thai cũng là những kẻ xâm nhập: Mặc dù có một số điểm tương đồng về mặt di truyền với mẹ, nhưng chúng cũng mang DNA của cha, nên đáng lẽ phải bị hệ miễn dịch của mẹ tiêu diệt.
Các nghiên cứu cho thấy nhau thai và khối u sử dụng các chiến lược tương tự để điều khiển hệ miễn dịch. Việc nghiên cứu cách nhau thai trốn tránh hệ miễn dịch giúp chúng ta phát hiện mục tiêu mới để can thiệp vào khối u. Một nghiên cứu năm 2024 từ nhóm của GS. Weiping Zou (ĐH Michigan) dùng kỹ thuật phân tích biểu hiện gen đơn bào (single-cell transcriptomics) để so sánh tế bào khối u và tế bào nuôi dưỡng.5 Họ phát hiện cả hai quần thể đều tăng biểu hiện B7-H4 – một phân tử điểm kiểm soát miễn dịch ức chế hoạt hóa tế bào T.
Sau đó, họ chứng minh bằng thực nghiệm tầm quan trọng của phân tử này tại vị trí tiếp giáp mẹ – thai và trong vi môi trường khối u bằng mô hình chuột. Chuột đột biến gene B7-H4 có khả năng bị tiêu thai cao hơn và xuất hiện nhiều tế bào T xâm nhập nhau thai hơn so với chuột thường. Quan trọng hơn, trong mô hình chuột ung thư vú, việc giảm nồng độ B7-H4 làm tăng hiệu quả của thuốc ức chế checkpoint miễn dịch, từ đó giảm tiến triển khối u và kéo dài thời gian sống.
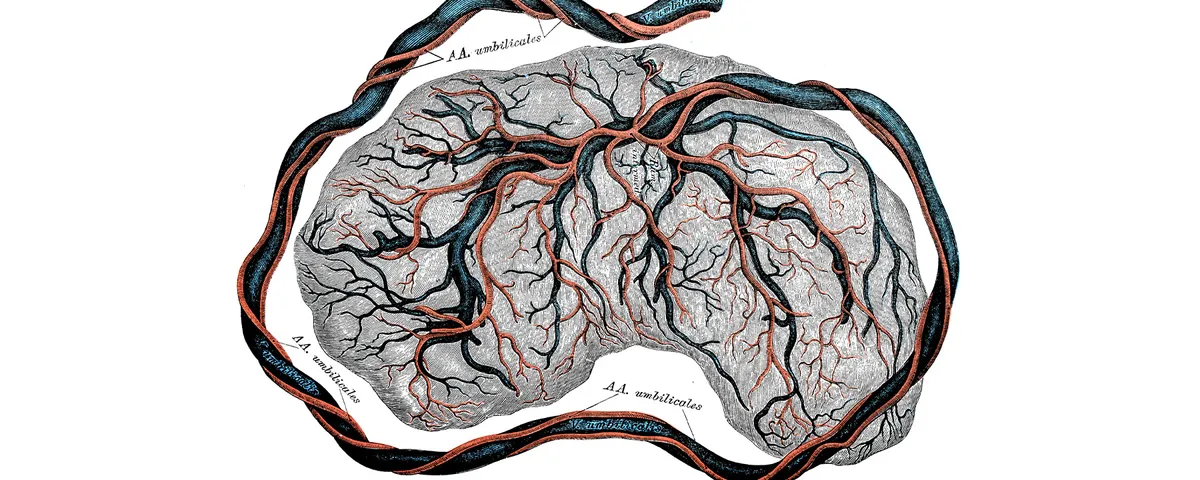
Nhưng đó chỉ là một trong những cách mà sinh học nhau thai có thể dẫn đến các hướng điều trị ung thư mới. Ở người, nhau thai xâm lấn cao, đưa các nhánh như ngón tay vào máu của mẹ. Tương tự, các khối u ác tính cũng phải xâm lấn mô xung quanh (gọi là lớp đệm) để lan rộng trong cơ thể. Trong khi phần lớn nghiên cứu trước đây tập trung vào cách nhau thai hoặc khối u xâm lấn mô, Kshitiz lại nghiên cứu chiều ngược lại: làm thế nào mô xung quanh kháng lại sự xâm lấn?
“Ung thư thường được xem như hạt giống trong đất,” ông nói. Đặc tính của hạt giống quyết định phần nào tốc độ phát triển, “nhưng cũng phụ thuộc vào đất – xem đất cho phép hạt phát triển đến mức nào.”
Ở người, sự khác biệt trong khả năng cho phép của nội mạc tử cung hoặc mô đệm có thể tinh tế và chịu ảnh hưởng bởi cả yếu tố môi trường lẫn di truyền, điều này khiến việc xác định chính xác gene nào trở nên khó khăn. Tuy nhiên, sự khác biệt giữa các loài lại rõ rệt hơn nhiều: Các loài linh trưởng và gặm nhấm có nhau thai rất xâm lấn (hoặc nội mạc rất dễ bị xâm nhập), nhưng các loài động vật có vú khác lại giỏi hơn trong việc thiết lập ranh giới: Chó, mèo có nhau thai xâm lấn trung bình và ngựa, bò thì mức xâm lấn tối thiểu.6
Kshitiz và đồng nghiệp đã so sánh hệ gene của nhiều loài trong phổ này và xác định hàng trăm gene có tương quan với mức độ xâm lấn, cũng như một vài yếu tố phiên mã đặc biệt quan trọng trong điều hòa các gene này.7 Sau đó, họ sử dụng mô hình mô 3D chứa tế bào người để nghiên cứu xem việc loại bỏ các yếu tố phiên mã này ảnh hưởng thế nào đến mức độ cho phép xâm nhập. Họ phát hiện rằng loại bỏ yếu tố phiên mã GATA2 (GATA binding protein 2) hoặc TFDP1 (Transcription Factor Dp-1) trong nguyên bào sợi nội mạc tử cung của người làm tăng đáng kể khả năng chống lại sự xâm lấn của tế bào nuôi dưỡng, tương tự như các loài có nhau thai ít xâm lấn như bò. Quan trọng hơn, loại bỏ các yếu tố này trong tế bào da cũng làm tăng khả năng kháng xâm nhập của tế bào u ác tính
“Về cơ bản, nếu chúng ta có thể khiến mô người giống như của bò, họ sẽ kháng xâm lấn tốt hơn,” Kshitiz nói. “Dĩ nhiên, vấn đề là ta không muốn biến toàn bộ người thành bò, nhưng chúng ta có thể khiến mô ở quanh khối u giống như của bò. Vì vậy, hiện tại chúng tôi đang phát triển một liệu pháp gene: lấy sinh thiết mô [khỏe mạnh] của bệnh nhân, điều chỉnh gene để làm cho mô này giống bò, rồi cấy lại gần khối u.”
Bằng cách này, nghiên cứu tỉ mỉ mối quan hệ mẹ-thai và chuỗi phân tử điều hòa quá trình xâm lấn tế bào, trốn tránh miễn dịch và các chức năng khác có lợi cho thai nhi, có thể mở ra những chiến lược mới để vô hiệu hóa các quá trình tương tự trong ung thư.
Tài liệu tham khảo
- Moss RW. The life and times of John Beard, DSc (1858-1924). Integr Cancer Ther. 2008;7(4):229-251.
- Costanzo V, et al. Exploring the links between cancer and placenta development.Open Biol. 2018;8(6):180081.
- Metzler VM, et al. Androgen dependent mechanisms of pro-angiogenic networks in placental and tumor development. Placenta. 2017;56:79-85.
- Coorens THH, et al. Inherent mosaicism and extensive mutation of human placentas.Nature. 2021;592(7852):80-85.
- Yu J, et al. Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance.Cell. 2024;187(17):4713-4732.e19.
- PrabhuDas M, et al. Immune mechanisms at the maternal-fetal interface: Perspectives and challenges. Nat Immunol. 2015;16(4):328-334.
- Suhail Y, et al. Tracing the cis-regulatory changes underlying the endometrial control of placental invasion. Proc Natl Acad Sci. 2022;119(6):e2111256119.
Nguồn: The Scientist
Link: https://www.the-scientist.com/optimizing-in-vitro-production-of-monocyte-derived-dendritic-cells-and-macrophages-72550