Medical Xpress, 12/10/2024
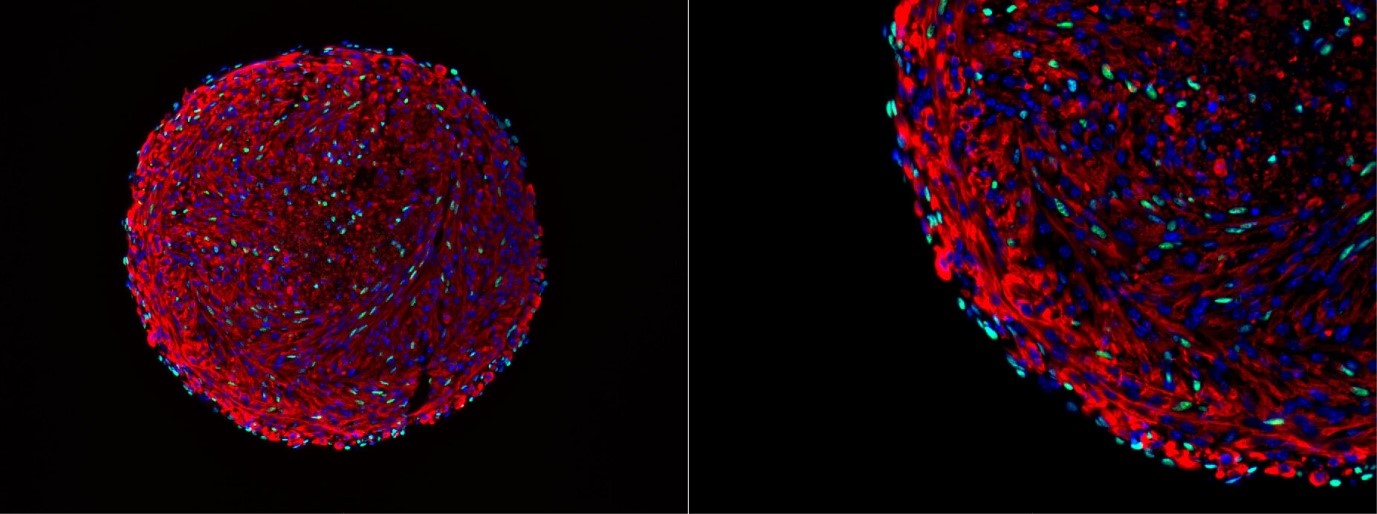
Hình ảnh kính hiển vi của một cơ quan cơ xương. Các tế bào xanh là các tế bào vệ tinh có nguồn gốc ở in vitro. Nguồn: Feodor Price
Các nhà sinh học tế bào gốc tại Harvard đã đi tiên phong trong phương pháp nuôi cấy cơ quan 3D mang tính đột phá để tạo ra số lượng lớn tế bào vệ tinh cơ xương trưởng thành, hay còn được gọi là tế bào gốc cơ in vitro.
Khả năng tạo ra tế bào gốc có chức năng hiệu quả theo cách này hứa hẹn sẽ thúc đẩy sự hiểu biết và phương pháp điều trị các bệnh liên quan đến cơ xương, bao gồm các bệnh nguồn gốc từ thần kinh cơ. Kỹ thuật mới này đưa ra một công cụ mạnh mẽ để nghiên cứu sinh học cơ được trình bày chi tiết trong Nature Biotechnology,.
“Mọi người sẽ có thể thực hiện tất cả các thí nghiệm ghép và tái tạo này khi đột nhiên, bạn có hàng triệu tế bào”, đồng tác giả Feodor Price của Đại học Harvard cho biết. “Hãy chơi với chúng, nghiên cứu chúng, xem xét các gen và con đường yêu thích của bạn trong phòng thí nghiệm”.
Price đã làm việc với Lee Rubin, Giáo sư tại Khoa Tế bào gốc và Sinh học tái tạo và đồng Chủ tịch Chương trình Bệnh hệ thần kinh của Viện Tế bào gốc Harvard, để tiên phong trong việc tạo ra các tế bào vệ tinh có nguồn gốc ở in vitro, rất giống với các tế bào gốc trưởng thành bản địa và chịu trách nhiệm cho sự phát triển và tái tạo cơ xương.
Phương pháp tiếp cận độc đáo của họ đã vượt qua thách thức trong việc duy trì khả năng tái tạo của các tế bào vệ tinh, khi nuôi cấy bên ngoài cơ thể bằng các phương pháp truyền thống. “Một khi bạn đưa chúng ra khỏi cơ thể, về cơ bản chúng không còn là tế bào gốc nữa”, Price giải thích.
Price giải thích thêm rằng khi các tế bào vệ tinh được nuôi cấy với mục tiêu tăng số lượng, chúng sẽ tăng sinh nhanh chóng nhưng sau đó tự động phân hóa thành nguyên bào cơ (tế bào tiền thân cơ), mất đi khả năng hoạt động ban đầu của tế bào vệ tinh. Điều này dẫn đến việc sửa chữa và duy trì cơ không hiệu quả khi các tế bào được cấy ghép trở lại cơ thể.
Bước đột phá của nhóm Harvard trong việc duy trì khả năng tái tạo của tế bào vệ tinh đến từ việc sử dụng các kỹ thuật nuôi cấy cơ quan 3D. Bằng cách đặt nguyên bào cơ chuột vào bình nuôi cấy quay, các nhà nghiên cứu có thể tạo ra các cơ quan chứa các sợi cơ đã biệt hóa và một quần thể tế bào biểu hiện dấu hiệu tế bào vệ tinh quan trọng Pax7. Sự hiện diện của yếu tố phiên mã quan trọng này và tổ chức cấu trúc bên trong cơ quan là những chỉ số về thành công của phương pháp của họ.
“Chúng tôi tin rằng mình đã tái tạo thành công hốc tế bào vệ tinh và vì thế, chúng tôi có thể làm cho các tế bào bên trong cơ quan đó biệt hóa ngược trở lại trạng thái tế bào vệ tinh” Price cho biết. Về cơ bản, chúng tôi đã tạo ra các tế bào vệ tinh ở in vitro, một thành tựu quan trọng mang lại nhiều hứa hẹn cho lĩnh vực y học tái tạo và sinh học cơ”.
Một loạt các đặc tính in vitro và in vivo cho thấy các tế bào gốc này rất giống với các tế bào vệ tinh thực sự, như là kích thước nhỏ, trạng thái nghỉ, các gen chính và các dấu hiệu biểu sinh. Tuy nhiên, chúng không hoàn toàn giống hệt với các tế bào gốc. Phân tích RNA và DNA cho thấy các tế bào được tạo ra trong phòng thí nghiệm có các đặc điểm phiên mã và biểu sinh trung gian giữa các tế bào vệ tinh và nguyên bào cơ.
Tuy nhiên, quan trọng nhất là khi được cấy vào cơ bắp của chuột, các tế bào này có thể cấy ghép, tái tạo lại hốc tế bào gốc, tồn tại lâu dài và tái tạo cơ bắp sau khi bị tổn thương nhiều lần – tất cả đều là chức năng chính của các tế bào gốc vệ tinh.
Trong một thí nghiệm, các nhà nghiên cứu đã chỉ ra rằng việc cấy ghép các tế bào mới (thay vì các nguyên bào cơ) vào cơ bắp của chuột được chiếu xạ, thiếu các tế bào vệ tinh nội sinh có thể dẫn đến tái tạo cơ bắp và có lực co bóp bình thường. Nguyên bào cơ đã làm những gì mong đợi: Không làm gì cả. Chúng không tạo ra cơ bắp.
So với các tế bào gốc và tế bào vệ tinh tạo ra cơ tốt hơn. Price cho biết: “Khi chúng tôi so sánh khả năng co bóp của chúng, chúng tôi rất vui mừng khi thấy về cơ bản lực tạo ra từ cơ co bóp đó là giống hệt nhau”.
Ông nói thêm, “Điều khiến tôi ấn tượng không phải là khả năng ghép tế bào. Mà là khả năng tái tạo hốc tế bào gốc của chúng, vì nếu chúng làm được như vậy, chúng sẽ vừa cấy ghép được và vừa tồn tại lâu dài”.
Các nhà nghiên cứu cũng có thể tạo ra các tế bào vệ tinh từ nguyên bào cơ của con người, bao gồm các dòng tế bào thương mại đã được cấy chuyền qua nhiều lần. Điều này có ý nghĩa quan trọng đối với sự phát triển của liệu pháp tế bào, vì làm việc với mô của con người rất khó khăn và hiện nay có thể sản xuất được số lượng lớn giống các tế bào vệ tinh có chức năng ở in vitro.
Nghiên cứu này được hỗ trợ bởi Blavatnik Biomedical Accelerator và Liên minh Chiến lược giữa Đại học Harvard và National Resilience do Văn phòng Phát triển Công nghệ (OTD) của Harvard thành lập để thúc đẩy nghiên cứu hướng tới các cơ hội thương mại hóa.
Dựa trên những tiến bộ này, nhóm nghiên cứu đã đặt nền móng cho một dự án hợp tác với các phòng thí nghiệm khác của Harvard để mô hình hóa toàn bộ mạch thần kinh cơ, với các ứng dụng tiềm năng cho các tình trạng như teo cơ tủy sống, ALS và loạn dưỡng cơ mặt, vai, cánh tay.
Rubin cho biết: “Phòng thí nghiệm của chúng tôi đã dành nhiều năm nghiên cứu về khía cạnh “thần kinh” của các bệnh thần kinh cơ. “Chúng tôi hiện đang mong đợi đến thời điểm có thể tạo ra một mạch máu hoàn toàn mới kéo dài từ tủy sống đến cơ có chức năng cao”.
Tài liệu tham khảo
Feodor D. Price et al, Organoid culture promotes dedifferentiation of mouse myoblasts into stem cells capable of complete muscle regeneration, Nature Biotechnology (2024). DOI: 10.1038/s41587-024-02344-7
Nguồn: Medical Xpress
Link: https://medicalxpress.com/news/2024-09-3d-organoid-culture-method-generate.html