The Scientist, 16/11/2020
Các nhà khoa học khám phá ra tiềm năng của tế bào gốc trung mô (MSC), còn biết đến như “tế bào thuốc”, điều biến hệ thống miễn dịch và tái tạo mô.
Những bí ẩn về một con kỳ giông tái sinh đuôi hay một con hải sâm hàn gắn nội tạng đã khiến con người và các nhà khoa học bối rối trong nhiều thế kỷ. Có lẽ ý tưởng rằng cơ thể con người có các cơ chế tương tự để tự chữa lành và sửa chữa là không hoàn toàn là không thể. Có các tế bào mạnh mẽ được gọi là tế bào gốc trung mô nằm trên 50.000-100.000 dặm của các mạch máu trong cơ thể con người. Những tế bào này có khả năng bắt đầu các dòng tín hiệu thúc đẩy quá trình sửa chữa và tái tạo mô.
Vào giữa những năm 1960, Marshall Urist, một bác sĩ phẫu thuật chỉnh hình tại Trung tâm Y tế Đại học California ở Los Angeles, đã làm cạn kiệt tất cả khoáng chất canxi photphat từ các mảnh xương. Urist lấy các phần xương đã khử khoáng còn lại và đặt chúng vào cơ của một con chuột trưởng thành và đưa ra phát hiện đáng ngạc nhiên rằng xương có thể hình thành trong mô cơ.1
Vào cuối những năm 1960, Arnold Caplan, hiện là giáo sư sinh học và là giám đốc Trung tâm Nghiên cứu xương tại Đại học Case Western Reserve, đã hoàn thiện một loại hỗn hợp môi trường nuôi cấy tế bào giúp chuyển đổi các tế bào mà ông phân lập được từ cánh và chân của phôi gà thành sụn, xương, hoặc cơ. Mục tiêu của ông là tìm ra các tín hiệu phân tử giúp biệt hóa các tế bào này thành các dòng mô chuyên biệt.
Khi Caplan biết được kết quả của Ursit, ông ấy đã rất tò mò. Caplan cho biết: “Tôi nhận ra rằng có những tế bào gốc – những tế bào có thể phản ứng với các phân tử cảm ứng mạnh phải tồn tại trong mô trưởng thành. Và vì vậy, xuất thân từ nền tảng chỉnh hình, tôi biết rằng có các tế bào ma thuật tồn tại trong tủy xương.”
Tủy xương có liên quan đến việc chữa bệnh chỉnh hình kể từ thời Aristotle, và một số nghiên cứu vào giữa những năm 1960 cho thấy sự tồn tại của các tế bào tiền thân liên quan đến xương. Cùng với một trong những nhà nghiên cứu sau tiến sĩ của mình, Stephen Haynesworth, Caplan đã bắt đầu tinh sạch các tế bào từ tủy xương của người để tìm kiếm các loại tế bào tạo xương, dựa trên cùng một loại hỗn hợp môi trường mà ông đã hoàn thiện cho các tế bào phôi gà.2
Caplan cho biết: “Môi trường kỳ diệu đó là thủ thuật cho toàn bộ công nghệ tế bào gốc trung mô. Trong môi trường đó, các tế bào từ tủy xương, rất hiếm – 1/100.000, 1/1.000.000 – bám vào đĩa Petri và phân chia nhanh như cháy rừng.”
Tế bào thuốc
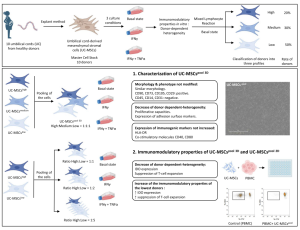
Caplan và nhóm của ông phát hiện ra rằng họ có thể điều khiển các tế bào tủy xương bám dính để biệt hóa thành cơ, sụn, xương hoặc mỡ trên đĩa nuôi cấy mô. Khả năng dễ dàng hình thành nhiều loại tế bào khác nhau từ lớp trung mô của cơ thể đã gợi ý một loại tế bào gốc trưởng thành mới, khiến Caplan đặt ra thuật ngữ “tế bào gốc trung mô (MSC)”.

Ảnh hiển vi điện tử quét màu (SEM) của tế bào gốc trung mô người (MSC)
“Hóa ra đó là một sai lầm,” Caplan nói. Các nhà khoa học vào thời điểm đó tin rằng các tế bào hoạt động trong quá trình nuôi cấy mô giống như chúng hoạt động trong cơ thể. “MSCs bên trong cơ thể bạn không bao giờ biệt hóa sụn, không bao giờ biệt hóa xương, không bao giờ biệt hóa mỡ. Vì vậy, trong cơ thể bạn, những tế bào này không phải là tế bào gốc,” Caplan nói. Thay vào đó, chúng còn nhiều hơn thế nữa.
Trong cơ thể, MSCs đóng một vai trò quan trọng trong việc duy trì các ổ tế bào gốc hoặc tế bào tiền thân và cân bằng nội môi. Chúng phát sinh từ các tế bào quanh mạch gọi là pericytes cư trú trên bề mặt của mọi mạch máu và hoạt động như một bộ lọc giữa các mạch máu và mô. Nếu một mạch máu trong bất kỳ mô nào bị tổn thương, pericytes rơi ra khỏi mạch và biệt hóa thành MSCs, sau đó điều phối sự hình thành các mạch và mô mới bằng cách thu hút và kích hoạt các tế bào gốc trưởng thành hoặc tế bào tiền thân đã có trong mô.
“Nếu bạn bị gãy xương, có một tế bào trong xương của bạn đã ở sẵn đó để tạo xương mới. Những gì MSC làm là tạm dừng tế bào đó, cung cấp cho nó một phân tử để khiến nó phân chia và tạo ra xương mới. MSC không tạo ra xương mới. MSC hướng dẫn, quản lý việc tái tạo mọi mô,” Caplan nói.
MSCs cũng hoạt động như các tế bào giám sát kiểm soát hệ thống miễn dịch và tiết ra các phân tử hoạt tính sinh học có ảnh hưởng. Chúng cảm nhận được những thay đổi trong môi trường tại chỗ và phản ứng lại bằng cách tiết ra một lượng lớn các chất điều hòa miễn dịch để giảm thiểu phản ứng miễn dịch của cơ thể, trong khi chúng tiết ra các phân tử có hoạt tính sinh học và hình thành chất nền ngoại bào để sửa chữa hoặc tái tạo mô tổn thương. Trong quá trình giám sát, MSCs cũng phát hiện các tín hiệu đau từ dây thần kinh và tiết ra các phân tử liên kết với các thụ thể opioid. Trong vòng vài phút, cảm giác đau đớn biến mất.
MSCs đóng vai trò như nhà máy sản xuất dược phẩm nội bộ mạnh mẽ chỉ đạo các cơ chế sinh học tự nhiên của cơ thể để giảm đau và kích hoạt tái tạo mô. Khi các nhà khoa học xác định chính xác hơn vai trò của MSCs trong cơ thể, Caplan đã tranh luận về việc đổi tên. Caplan nói: “Thay vì gọi chúng là ‘tế bào gốc trung mô’, tôi đã đổi tên chúng thành ‘tế bào thuốc,’”
Sự sống và tái sinh
Caplan đã nhận ra tiềm năng của những tế bào này trong điều trị nhiều loại bệnh và bắt đầu tìm đến các nhà đầu tư để được giúp đỡ tài trợ cho các liệu pháp tế bào dựa trên MSC. Mỗi ngày, các nhà khoa học trong các phòng thí nghiệm hàn lâm đưa ra những khám phá sâu sắc. Tuy nhiên, nhiều khám phá này không bao giờ tạo ra các loại thuốc hoặc phương pháp điều trị mới vì nhiều nhà khoa học nghiên cứu cơ bản thiếu mạng lưới và vốn cần thiết để chuyển các nghiên cứu cơ bản thành các sản phẩm điều trị. Ngoài ra, nhiều công ty dược phẩm sinh học coi nghiên cứu cơ bản giai đoạn đầu là một khoản đầu tư rủi ro.5,6 Trên thực tế, trong năm 2017, các công ty được đầu tư mạo hiểm hậu thuẫn đã sản xuất nhiều loại thuốc được chấp thuận hơn các công ty dược quy mô lớn truyền thống.6
Ban đầu, Caplan đã bị một số nhà đầu tư từ chối. Sau đó, ông gặp Kevin Kimberlin, chủ tịch của Spencer Trask & Co., một công ty phát triển công nghệ tiên tiến với di sản là giúp các kỹ sư, nhà khoa học và doanh nhân phát triển các phát hiện khoa học thành các công ty dẫn đầu thị trường. Kimberlin đã quen thuộc với tiềm năng của liệu pháp tế bào, trước đó đã được cấp bằng sáng chế và phát triển cơ sở kỹ thuật cho liệu pháp miễn dịch dựa trên tế bào đầu tiên được phê duyệt với Jonas Salk của Viện Khoa học Sinh học The Salk. Kimberlin cho biết: “Chúng tôi nhận thấy rằng MSCs có thể trở thành nền tảng quan trọng trong lĩnh vực y học mới này, vì vậy chúng tôi cam kết tìm cách thương mại hóa khám phá của Caplan.”
Trong cuộc gặp đầu tiên, Caplan đã cho Kimberlin thấy rằng ông có thể tách chiết MSCs từ tủy xương, tăng sinh chúng trong môi trường nuôi cấy, và sau đó truyền chúng đến những vị trí tổn thương cụ thể. Trong cơ thể, các MSCs được truyền vào dường như sửa chữa xương và sụn cùng một lúc và ở những vị trí thích hợp.
“Tôi rất ấn tượng khi ông ấy giải thích cách mà quần thể MSC tự nhiên của chúng ta giảm dần khi chúng ta già đi, nhưng ông ấy có thể tách chiết và tăng sinh chúng để có thể mang lại cho chúng ta khả năng phục hồi của tuổi trẻ,” Kimberlin nói. “Tôi nói, ‘Bạn đã khám phá ra khả năng chữa lành bệnh cho mọi người; Tôi không biết chúng ta sẽ xây dựng một công ty xung quanh vấn đề này như thế nào, nhưng chúng ta phải cố gắng.’” Hai người cùng nhau khởi động một liên doanh công nghệ sinh học có tên Osiris Therapeutics Inc., được họ đặt tên theo vị thần của sự sống và tái sinh của Ai Cập.
Osiris Therapeutics đã trở thành động lực thúc đẩy một số khám phá ban đầu dựa trên MSC, mở rộng cả kiến thức khoa học về các tế bào này và phát triển các liệu pháp trong thế giới thực. Một danh mục lớn các sản phẩm ma trận tế bào đã nổi lên để điều trị loét da, bỏng, vết thương nặng và sản phẩm ma trận tế bào có thể cấy ghép đầu tiên đã được phê duyệt. Đáng kinh ngạc nhất, các nhà nghiên cứu Osiris nhận ra rằng MSC có thể được chế tạo thành một phương tiện vận chuyển thuốc, phục vụ như một hiệu thuốc cho các vị trí tổn thương.

Nhà khoa học làm việc trong phòng thí nghiệm
Trong một nghiên cứu ban đầu có tầm ảnh hưởng, các nhà khoa học tại Osiris Therapeutics và các cộng sự của họ đã sử dụng MSCs để điều trị 12 trẻ em mắc bệnh mảnh ghép chống chủ kháng steroid (GvHD). Trẻ mắc bệnh này bị phản ứng miễn dịch dữ dội với quá trình cấy ghép tế bào gốc tạo máu, nơi cơ thể tự tấn công, khiến lớp niêm mạc ruột bị bong ra. Ước tính khoảng 20% trẻ em bị bệnh GvHD kháng thuốc điều trị bằng steroid, tử vong. Trong thử nghiệm Osiris, 7 trong số 12 trẻ em được truyền MSC cho thấy bệnh thuyên giảm hoàn toàn sau một tháng và 95% trẻ em sống ít nhất sáu tháng, một sự cải thiện đáng kể so với tỷ lệ sống sót thông thường 25% đối với trẻ em điều trị bằng phương pháp ức chế miễn dịch ruyền thống.8 Trong nghiên cứu này và trong các nghiên cứu liệu pháp tế bào MSC ban đầu khác, các nhà nghiên cứu không quan sát thấy phản ứng bất lợi nào,3 và cách tiếp cận này trở thành liệu pháp tế bào có hệ thống đầu tiên trên thế giới.7
Các nhà nghiên cứu lâm sàng hiện đang tiến hành các thử nghiệm để khám phá công dụng của MSCs trong điều trị COVID-19.9 Một nghiên cứu sơ bộ được thực hiện tại Bệnh viện Mount Sinai ở Thành phố New York đã báo cáo thành công với 11 trong số 13 bệnh nhân COVID-19 bị bệnh nặng. Điều trị MSC làm giảm viêm, tăng số lượng tế bào T chống lại vi rút và sửa chữa hoặc tái tạo mô phổi.10
“Đưa MSC từ một cái nhìn sâu sắc đáng kinh ngạc về loại thuốc tế bào đồng loài đầu tiên là một câu chuyện nhắc nhở chúng ta về lý do tại sao công việc của các nhà khoa học cơ bản lại quan trọng đến vậy và tại sao việc phát triển khoa học cơ bản vào thực tiễn cũng quan trọng như vậy,” Kimberlin nhận xét.
Ngày nay, có khoảng 1.195 thử nghiệm lâm sàng đang được tiến hành để khám phá việc sử dụng MSCs trong điều trị hơn 900 bệnh lý, bao gồm viêm khớp dạng thấp, nhồi máu cơ tim cấp tính, đột quỵ, bệnh Crohn, suy tim mãn tính, đau thắt lưng, v.v. “Sự khác biệt giữa dược phẩm truyền thống và liệu pháp dựa trên tế bào ở chỗ dược phẩm là một loại thuốc đơn lẻ, độ tinh sạch cao, có chức năng rất rõ ràng. Ngược lại, một MSC sẽ đến vị trí tổn thương, quan sát xung quanh, phân tích mọi thứ đang diễn ra và sau đó tạo thuốc,” Caplan chia sẻ.
Kimberlin cho biết: “Chúng tôi đang bắt đầu những gì tôi hy vọng sẽ có hàng trăm cách sử dụng MSC để chữa lành các bệnh không thể điều trị. Đó là điều mà tất cả chúng ta có thể mong đợi.”
“Thật vui khi biết rằng tôi có bản năng thành lập công ty phù hợp vì đó là cách duy nhất mà công nghệ này có được nguồn lực để phát triển. Chúng tôi đang nhìn vào phạm vi hiểu biết và nói, ‘Làm thế nào chúng ta có thể có tầm nhìn tốt hơn và sáng hơn?’” Caplan nói.
Kimberlin khen Caplan đã khám phá ra kiến thức mới này, chia sẻ nó và khuyến khích những người khác bổ sung và phê bình nó. Công việc không mệt mỏi của ông ấy là chuyển những hiểu biết sâu sắc này thành sản phẩm để cứu sống hàng trăm trẻ em.
Kimberlin kết luận: “Đối với tôi, kiểu đổi mới khoa học này là biểu hiện cao nhất của đạo đức tốt và Tiến sĩ Caplan là tấm gương tiêu biểu cho mục đích cao cả này.”
Ở tuổi 78, Caplan vẫn mạo hiểm vào phòng thí nghiệm của mình hàng ngày, thường dành 60-80 giờ mỗi tuần để nghiên cứu những ý tưởng và khám phá mới. Caplan nói: “Tôi là một học giả, và theo nghĩa triết học, vai trò của tôi trong xã hội là tiếp tục bổ sung thông tin mới. Và đó là cách xã hội tiến triển từ thời kỳ đồ đá đến thời đại hiện nay. Chúng tôi tiếp tục bổ sung kiến thức, và chúng tôi tiếp tục biến kiến thức thành trí tuệ. Tôi vẫn làm vì tôi có thể nhìn thấy ánh sáng cuối đường hầm. Đối với một nhà khoa học cơ bản thấy được công việc của mình đưa ra được liệu pháp điều trị mới thực sự là một món quà to lớn.”
Tài liệu tham khảo:
- M.R. Urist, “Bone: Formation by autoinduction,” Science, 150:893–899, 1965.
- A. I. Caplan, “Mesenchymal Stem Cells: Time to Change the Name!” Stem Cell Translational Medicine, 6:1445-1451, 2017.
- A. I. Caplan, “Why are MSCs therapeutic? New data: new insight,” Journal of Pathology, 217: 318-324, 2009.
- R. Somoza, D. Correa, and A.I. Caplan, “Roles for mesenchymal stem cells as medicinal signaling cells,” Nature Protocols: Recipes for Researchers, 2016. Accessed October 11, 2020.
- F. Sanchez-Guijo, et. al., “Adipose-derived mesenchymal stromal cells for the treatment of patients with severe SARS-CoV-2 pneumonia requiring mechanical ventilation. A proof of concept study,” The Lancet, 25:100454, 2020.
- W. Karpa and A. Grginovic, “Long-term perspective on venture capital investments in early stage life-science projects related to health care,” Economic Research-Ekonomska Istrazivanja, (33)1:2526-2540, 2020.
- Osiris Therapeutics Inc., “Timeline Express Announcements Archive,” Accessed October 11, 2020.
- K. Le Blanc, et. al., “Mesenchymal stem cells for treatment of steroid-resistant, severe, acute graft-versus-host disease: a phase II study,” Lancet, 371:1579–1586, 2008.
- K. Kimberlin, “The Treatment That Could Crush COVID,” The Wall Street Journal, 2020. Accessed October 11, 2020. https://www.wsj.com/articles/the-treatment-that-could-crush-covid-11597360709
- R. Murphey, “Biopharma VC Basics 1: What do VCs do?” Bay Bridge Bio, 2020. Accessed October 11, 2020.
Nguồn: The Scientist