Scientific Reports, 04/08/2025
Xơ phổi (PF – Pulmonary fibrosis ) là một căn bệnh tiến triển, không thể đảo ngược, với các phương pháp điều trị hiện tại còn hạn chế và không hiệu quả hoàn toàn. Đặc biệt, xơ phổi vô căn (IPF – idiopathic pulmonary fibrosis), loại phổ biến nhất của bệnh phổi kẽ, có tiên lượng xấu hơn nhiều loại ung thư, với thời gian sống trung bình chỉ 3-5 năm. Pirfenidone (PFD) được khuyến nghị điều trị IPF, nhưng hiệu quả đơn trị liệu bị hạn chế do cần liều cao và có nhiều tác dụng phụ. Nhu cầu tìm kiếm một phương pháp điều trị hiệu quả và khẩn cấp cho bệnh nhân xơ phổi là vô cùng cấp bách.
Một nghiên cứu mới đây được công bố trên Scientific Reports đã mang lại hy vọng lớn, cho thấy liệu pháp kết hợp giữa PFD và tế bào gốc trung mô có nguồn gốc từ dây rốn người (UC-MSCs – umbilical cord-derived mesenchymal stem cells) có khả năng đảo ngược xơ phổi do bleomycin gây ra.
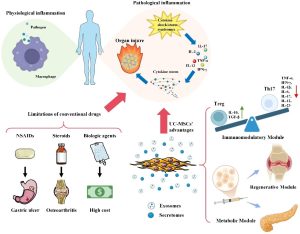
UC-MSCs: Một liệu pháp đầy hứa hẹn UC-MSCs đang được ứng dụng rộng rãi trong các nghiên cứu tiền lâm sàng về y học tái tạo phổi. Chúng có nhiều ưu điểm nổi bật như khả năng sẵn có cao, quy trình thu thập an toàn, không gặp hạn chế về đạo đức và tính miễn dịch thấp. Mặc dù các nghiên cứu trước đây đã so sánh hiệu quả của PFD hoặc nintedanib với các loại MSCs khác nhau (tủy xương, mô mỡ hoặc dây rốn) trong điều trị các mô hình xơ hóa do bleomycin gây ra, nhưng nghiên cứu về sự kết hợp giữa thuốc chống xơ hóa truyền thống và MSCs còn hạn chế.
Nghiên cứu này đã sử dụng mô hình chuột C57BL/6 bị xơ phổi do tiêm bleomycin để đánh giá hiệu quả điều trị của PFD, UC-MSCs và liệu pháp kết hợp của chúng. Chuột được chia thành 09 nhóm, bao gồm nhóm đối chứng, nhóm mô hình, nhóm PFD, các nhóm UC-MSCs ở các liều khác nhau (0.5 × 106, 1.0 × 106 và 2.0 × 106 tế bào/con), và các nhóm kết hợp PFD + UC-MSCs.
Kết quả nghiên cứu cho thấy những cải thiện đáng kể:
- Cải thiện chức năng phổi: Cả nhóm sử dụng liều cao UC-MSCs đơn thuần và nhóm kết hợp PFD + liều cao UC-MSCs đều cho thấy sự cải thiện đáng kể về chức năng phổi ở chuột bị IPF, với các chỉ số như thời gian thở ra (Te), chỉ số đánh giá sức cản đường thở (Penh), Dung tích sống gắng sức (FVC), lưu lượng hít vào đỉnh (PIF), Độ giãn nở động của phổi (Cydn) và Thể tích khí lưu thông (TV) được phục hồi rõ rệt, gần với các giá trị của nhóm đối chứng và không có sự khác biệt thống kê.
- Giảm viêm và lắng đọng collagen:
- Mức độ của các yếu tố gây viêm như TGF-β1, INF-γ và IL-6 trong huyết thanh, dịch rửa phế quản phế nang (BALF – bronchoalveolar lavage fluid) và mô phổi đã giảm đáng kể ở các nhóm điều trị so với nhóm mô hình.
- Số lượng tế bào viêm (tổng tế bào, bạch cầu trung tính, lympho bào và đại thực bào) trong BALF cũng giảm đáng kể sau điều trị.
- Mức độ hydroxyproline (HYP), một dấu hiệu thay thế cho hàm lượng collagen, trong mô phổi cũng giảm đáng kể ở các nhóm điều trị, cho thấy sự chậm lại quá trình lắng đọng collagen và xơ hóa.
- Đảo ngược tổn thương mô bệnh học và các dấu hiệu xơ hóa:
- Quan sát dưới kính hiển vi cho thấy sự thâm nhiễm tế bào viêm giảm và cấu trúc phổi được cải thiện ở các nhóm điều trị.
- Các dấu hiệu xơ hóa như α-SMA và Collagen I, cùng với p-SMAD 2/3 (một chỉ số của con đường TGF-β/SMAD) đã giảm đáng kể.
- Đáng chú ý, nhóm PFD + UC-MSCs liều cao cho thấy hiệu quả giảm p-SMAD 2/3 rõ rệt nhất và ức chế biểu hiện gen tiền xơ hóa mạnh hơn.
- Giảm tác dụng phụ của PFD: Nghiên cứu cũng quan sát thấy rằng sự kết hợp với UC-MSCs đã phần nào giảm bớt các phản ứng phụ đường tiêu hóa do PFD gây ra ở chuột, điều này có thể nâng cao khả năng dung nạp và tuân thủ điều trị PFD ở bệnh nhân IPF trong môi trường lâm sàng.
Trong quá trình sinh bệnh học của IPF, các phản ứng viêm dai dẳng kích thích sự tăng sinh quá mức của nguyên bào sợi, cuối cùng dẫn đến xơ hóa. Con đường TGF-β đóng vai trò then chốt trong sự khởi đầu và duy trì xơ hóa. PFD không chỉ có tác dụng chống viêm và chống oxy hóa mà còn ức chế xơ hóa bằng cách ngăn chặn con đường TGF-β/SMAD, từ đó giảm tổng hợp collagen. UC-MSCs, khi kết hợp với PFD, có thể tăng cường hiệu quả chống xơ hóa vì PFD có thể ức chế một phần sự tiết các yếu tố tiền xơ hóa như TGF-β từ UC-MSCs, làm cho liệu pháp kết hợp hiệu quả hơn khi sử dụng UC-MSCs đơn thuần.
Nghiên cứu này đã chứng minh rằng việc điều trị bằng UC-MSCs đơn thuần hoặc kết hợp PFD + UC-MSCs mang lại hiệu quả vượt trội hơn so với PFD đơn thuần trong việc phục hồi chức năng phổi và giảm viêm. Đặc biệt, liệu pháp kết hợp PFD và UC-MSCs cho thấy tác dụng ức chế rõ rệt hơn đối với các gen tiền xơ hóa và ức chế sự hoạt hóa của con đường TGF-β/SMAD, từ đó đảo ngược một phần sự tiến triển của xơ hóa. Những phát hiện này mở ra một triển vọng mới đầy hứa hẹn cho việc điều trị xơ phổi trong tương lai.
Tuy nhiên, nghiên cứu này chủ yếu tập trung vào giai đoạn sớm của xơ hóa. Các nghiên cứu tiếp theo sẽ cần khám phá hiệu quả điều trị của liệu pháp kết hợp này ở giai đoạn xơ hóa mãn tính của mô hình IPF, cũng như đi sâu hơn vào cơ chế cơ bản của liệu pháp kết hợp này.
Tài liệu tham khảo
Bài viết được dịch và tóm tắt từ bài báo (nếu có): Xu, J., Abudureheman, Z., Gong, H., Zhong, X., Xue, L., Zou, X., & Li, L. (2025). Pirfenidone combined with UC-MSCs reversed bleomycin-induced pulmonary fibrosis. Scientific Reports, 15(1), 28339.
Nguồn: Scientific Reports
Link: https://www.nature.com/articles/s41598-025-14286-4#citeas