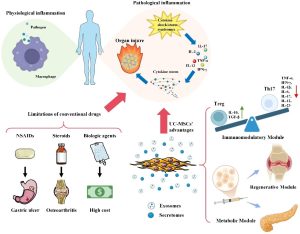
The FASEB Journal, 02/12/2025
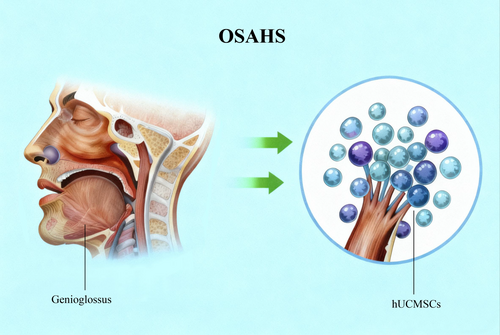
Cơ genioglossus là một đích điều trị then chốt trong hội chứng ngưng thở – giảm thở khi ngủ do tắc nghẽn (OSAHS). Tế bào gốc trung mô dây rốn người (hUC-MSCs), với đặc tính tái tạo mô và tính sinh miễn dịch thấp, mang lại một chiến lược đầy hứa hẹn cho việc phục hồi chức năng cơ này.
Giới thiệu
Hội chứng ngưng thở – giảm thở khi ngủ do tắc nghẽn (Obstructive Sleep Apnea Hypopnea Syndrome, OSAHS) được đặc trưng bởi các đợt xẹp tái diễn của đường hô hấp trên trong khi ngủ. Sự thông thoáng của đường thở phụ thuộc chủ yếu vào hoạt động co bóp hiệu quả của các cơ giãn đường thở trên. Trong sinh lý bệnh của OSAHS, thiếu oxy gián đoạn mạn tính (chronic intermittent hypoxia, CIH) đóng vai trò then chốt, gây tổn thương cấu trúc và làm thay đổi tính dẻo của các cơ giãn, từ đó thúc đẩy tình trạng tắc nghẽn đường thở.
Cơ genioglossus (cơ cằm-lưỡi) là cơ giãn chính của đường hô hấp trên và giữ vai trò trung tâm trong cơ chế bệnh sinh của OSAHS. Do đó, các chiến lược điều trị nhằm tăng cường chức năng của cơ genioglossus được xem là hướng tiếp cận đầy tiềm năng trong cải thiện quản lý lâm sàng OSAHS.
Hiện nay, các phương pháp điều trị OSAHS bao gồm thông khí áp lực dương liên tục (CPAP), dụng cụ đưa hàm dưới ra trước (MAD) và kích thích thần kinh hạ thiệt (HNS), cùng với luyện tập cơ đường thở trên như một liệu pháp hỗ trợ. Tuy nhiên, mỗi phương pháp đều tồn tại những hạn chế nhất định liên quan đến khả năng tuân thủ, phạm vi chỉ định và hiệu quả điều trị. Đáng chú ý, hiện vẫn chưa có liệu pháp dược lý nào được phê duyệt nhằm cải thiện trực tiếp chức năng cơ đường thở trên, nhấn mạnh nhu cầu phát triển các chiến lược điều trị nhắm trúng đích, đặc biệt đối với cơ genioglossus.
Liệu pháp tế bào gốc trung mô (Mesenchymal Stem Cells – MSCs) đã nổi lên như một hướng nghiên cứu đầy hứa hẹn trong y học tái tạo nhờ khả năng tự làm mới, biệt hóa đa dòng và thúc đẩy sửa chữa mô. Trong số các nguồn MSCs, tế bào gốc trung mô dây rốn người (Human Umbilical Cord Mesenchymal Stem Cells – hUC-MSCs) nổi bật với khả năng biệt hóa cao, tính sinh miễn dịch thấp, nguồn cung dồi dào và không vướng mắc các vấn đề đạo đức, tạo điều kiện thuận lợi cho ứng dụng lâm sàng.
Các nghiên cứu gần đây cho thấy MSCs có tiềm năng điều trị trong OSAHS thông qua việc điều hòa đáp ứng viêm và phục hồi tổn thương mô do thiếu oxy gián đoạn; đồng thời, tế bào gốc tủy răng đã được chứng minh có khả năng bảo vệ cơ genioglossus khỏi tổn thương do thiếu oxy. Tuy nhiên, vai trò bảo vệ của hUC-MSCs đối với tổn thương cơ genioglossus trong OSAHS vẫn chưa được làm rõ. Tổng quan này nhằm tổng hợp các bằng chứng hiện có và đánh giá tiềm năng điều trị của hUC-MSCs trong việc giảm thiểu tổn thương cơ genioglossus liên quan đến OSAHS.
Mô hình PALM
Tính không đồng nhất của hội chứng ngưng thở – giảm thở khi ngủ do tắc nghẽn (OSAHS), như được khái niệm hóa trong mô hình PALM—bao gồm áp lực đóng tới hạn của hầu (Pharyngeal critical closing pressure, Pcrit), ngưỡng thức tỉnh (arousal threshold), hệ số khuếch đại vòng phản hồi hô hấp (loop gain) và khả năng đáp ứng của cơ đường thở (muscle responsiveness), được phản ánh qua sự đa dạng của các yếu tố nguy cơ, biểu hiện lâm sàng và đặc biệt là các cơ chế sinh lý bệnh nền tảng. Những khác biệt này thường chưa được xem xét đầy đủ trong quá trình phát triển các công cụ chẩn đoán và chiến lược điều trị. Các nghiên cứu gần đây nhấn mạnh tầm quan trọng lâm sàng của việc phân nhóm kiểu hình OSAHS trong y học chính xác, qua đó hỗ trợ triển khai các chiến lược điều trị và quản lý cá thể hóa theo từng kiểu hình cụ thể.
Khung lý thuyết do Wellman, Eckert và cộng sự đề xuất xác định bốn thành phần sinh lý bệnh then chốt góp phần vào OSAHS, bao gồm: tắc nghẽn cơ học đường hô hấp trên, khả năng đáp ứng của cơ đường thở trên, sự mất ổn định của kiểm soát thông khí (loop gain) và mức độ dễ thức tỉnh của hệ thần kinh trung ương. Việc nhận diện các đặc điểm sinh lý riêng biệt này mở ra khả năng phát triển các can thiệp điều trị nhắm trúng đích, từ đó nâng cao và tối ưu hóa hiệu quả điều trị bệnh nhân theo hướng y học cá thể hóa.
Mô hình PALM cung cấp một khuôn khổ toàn diện để lý giải cả các yếu tố cấu trúc và phi cấu trúc liên quan đến khởi phát và tiến triển của OSAHS, bao gồm Pcrit tăng cao, ngưỡng thức tỉnh thấp, loop gain tăng và suy giảm chức năng các cơ giãn đường thở trên, đặc biệt là cơ genioglossus. Các yếu tố này có mối liên hệ chặt chẽ với nhau, cùng góp phần gây xẹp đường hô hấp trên trong khi ngủ và đại diện cho những đích can thiệp tiềm năng (Hình 1). Đáng chú ý, tổn thương cơ genioglossus có thể khởi phát hoặc làm trầm trọng thêm OSAHS thông qua việc làm giảm độ thông thoáng của đường thở.
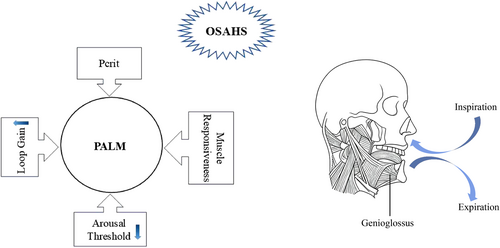
Hình 1. Sơ đồ mô hình PALM. Cơ genioglossus, được chi phối bởi thần kinh hạ thiệt, bình thường co trong thì hít vào để duy trì độ thông thoáng đường thở; sự suy giảm chức năng của cơ này trong khi ngủ phản ánh thất bại bù trừ thần kinh–cơ và, trong bối cảnh Pcrit, loop gain và ngưỡng thức tỉnh bất lợi, góp phần gây ra hoặc làm nặng thêm OSAHS.
Việc hiểu rõ căn nguyên đa yếu tố của OSAHS là nền tảng quan trọng để định hướng lựa chọn các chiến lược điều trị hiệu quả và cá thể hóa. Sự thiếu vắng các liệu pháp dược lý được phê duyệt nhằm tác động trực tiếp lên chức năng cơ đường thở trên vẫn là một thách thức lâm sàng lớn. Do đó, làm sáng tỏ các cơ chế bệnh sinh nền tảng của OSAHS có ý nghĩa then chốt đối với việc phát hiện và phát triển các liệu pháp thuốc mới.
Tác động của OSAHS lên cơ genioglossus
- Stress oxy hóa, mệt mỏi cơ và chuyển hóa năng lượng ty thể
- Stress oxy hóa tăng cao trong OSAHS:
Bệnh nhân OSAHS có nồng độ các loại oxy phản ứng ROS (Reactive Oxygen Species) và stress oxy hóa toàn thân tăng; các mô hình động vật cũng ghi nhận stress oxy hóa gia tăng trong cơ xương, bao gồm cơ genioglossus.
- Thành phần sợi cơ quyết định khả năng kháng mệt mỏi:
Cơ đường thở trên có cấu trúc sợi cơ đa dạng; sợi co chậm kháng mệt nhờ chuyển hóa oxy hóa, trong khi sợi co nhanh dễ mệt do phụ thuộc đường phân.
- Biến đổi sợi cơ genioglossus trong OSAHS:
OSAHS gây thay đổi tiến triển về thành phần và chức năng sợi cơ genioglossus, dẫn đến tổn thương cấu trúc, suy giảm chức năng và làm trầm trọng thêm xẹp đường thở, tạo vòng xoắn bệnh lý mệt mỏi cơ – suy hô hấp.
- Vai trò trung tâm của ty thể:
Ty thể là nguồn năng lượng chính của tế bào cơ; thiếu oxy gián đoạn mạn tính (CIH) gây tổn thương ty thể trong cơ genioglossus, làm suy giảm chức năng sinh năng lượng.
- ROS ty thể và rối loạn chuỗi hô hấp:
ROS từ ty thể làm tổn thương chuỗi vận chuyển electron (ETC), giảm tổng hợp ATP và gây thiếu hụt năng lượng tế bào.
- Mất cân bằng ETC – ATP (Adenosine Triphosphate):
Sự mất cân bằng giữa hoạt động ETC và nhu cầu ATP dẫn đến cạn kiệt ATP, tích tụ ROS, sưng ty thể, mất điện thế màng và suy giảm năng lực sinh năng lượng.
- Siêu phức hợp chuỗi hô hấp:
Ty thể hình thành các siêu phức hợp gồm phức hợp I–III–IV nhằm tăng hiệu quả truyền electron, giảm sinh ROS và bảo tồn cấu trúc ETC.
- Viêm và apoptosis
- Thiếu oxy kích hoạt stress oxy hóa – HIF-1α:
Tình trạng thiếu oxy làm tăng sản sinh ROS, từ đó hoạt hóa và tăng biểu hiện yếu tố cảm ứng thiếu oxy-1α (Hypoxia-Inducible Factor-1α – HIF-1α).
- Đáp ứng viêm hệ thống do thiếu oxy:
Thiếu oxy gây đáp ứng viêm toàn thân kèm hiệu ứng dị hóa mạnh, thúc đẩy thoái hóa protein cơ xương và protein chức năng nội tạng, góp phần vào rối loạn chuyển hóa toàn thể.
- HIF-1α và mất cân bằng cytokine:
Tích lũy HIF-1α trong nhân tế bào làm tăng tiết các cytokine tiền viêm như TNF-α và IL-6, đồng thời ức chế các cytokine kháng viêm như IL-10.
- Hoạt hóa trục NF-κB:
Con đường tín hiệu NF-κB được kích hoạt trong điều kiện thiếu oxy, khuếch đại phản ứng viêm thông qua việc tăng biểu hiện các chất trung gian tiền viêm, bao gồm TNF-α, IL-1β và IL-6.
- Viêm tại cơ genioglossus trong CIH:
CIH làm tăng biểu hiện TNF-α và IL-6 tại cơ genioglossus, gây rối loạn chuyển hóa protein và thúc đẩy các biến đổi cấu trúc dẫn đến tổn thương cơ.
- ROS và tổn thương ty thể:
ROS dư thừa trong các pha thiếu oxy – tái oxy hóa gây tổn thương màng tế bào và bào quan, đặc biệt là ty thể, làm giảm điện thế màng ty thể và suy giảm chức năng ty thể.
- Khởi phát apoptosis:
Điều kiện thiếu oxy gây tổn thương oxy hóa và kích hoạt apoptosis ở nguyên bào cơ genioglossus; các mô hình CIH trên động vật cho thấy bất thường siêu cấu trúc và rối loạn chức năng ty thể trong cơ genioglossus.
- Hệ quả chức năng:
Rối loạn ty thể liên quan trực tiếp đến suy giảm khả năng co bóp của cơ đường thở trên, mất kiểm soát stress oxy hóa và gia tăng hoạt tính apoptosis, góp phần làm nặng thêm OSAHS.
- Tiến triển nghiên cứu về tác dụng bảo vệ của hUC-MSCs đối với cơ genioglossus trong OSAHS
Giá trị mà tế bào gốc trung mô dây rốn người (Human Umbilical Cord Mesenchymal Stem Cells – hUC-MSCs) mang lại cho nghiên cứu dựa trên tế bào và các ứng dụng điều trị ngày càng được công nhận rộng rãi. Các tế bào này sở hữu nhiều đặc tính ưu việt, bao gồm khả năng tăng sinh cao, tính sinh miễn dịch thấp, khả năng mở rộng ổn định trong điều kiện nuôi cấy in vitro, dễ dàng thu nhận từ nhiều nguồn và ít rào cản về mặt đạo đức. Ngoài ra, hUC-MSCs còn có tiềm năng biệt hóa đa dòng, có thể biệt hóa thành các tế bào có nguồn gốc từ cả ba lá phôi.
Hiệu quả điều trị của hUC-MSCs đã được chứng minh rõ ràng trong nhiều mô hình bệnh lý tiền lâm sàng khác nhau, qua đó làm nổi bật tiềm năng ứng dụng của hUC-MSCs trong y học tái tạo và các chiến lược điều trị dựa trên tế bào.
- Khả năng định vị, di cư và biệt hóa định hướng của MSCs
- Cơ chế tác động chủ yếu qua paracrine:
Các đặc tính chức năng của MSCs chủ yếu xuất phát từ hoạt tính cận tiết, thông qua việc tiết các yếu tố sinh học hòa tan và/hoặc biểu hiện các phân tử gắn màng, bao gồm phân tử kết dính, chemokine, enzyme, yếu tố tăng trưởng và interleukin.
- Homing và di cư hướng đích:
Quá trình homing hóa hướng động của MSCs được điều hòa bởi tương tác giữa các phân tử kết dính như VCAM-1, PECAM-1, ICAM-1, CD44, cùng với yếu tố tăng trưởng tế bào gan (HGF) và matrix metalloproteinase-2 (MMP-2), giúp MSCs được huy động chọn lọc đến các mô bị tổn thương.
- Tín hiệu tổn thương mô:
Khi mô bị tổn thương, nhiều phân tử hoạt tính sinh học được giải phóng vào vi môi trường dưới dạng tín hiệu liên quan đến tổn thương (damage-associated signals), đóng vai trò quan trọng trong việc thu hút và điều hướng tế bào gốc đến vùng tổn thương.
- Biệt hóa định hướng:
Trong các điều kiện cảm ứng thích hợp, MSCs có khả năng biệt hóa thành nhiều dòng tế bào khác nhau, bao gồm tế bào xương, sụn, mỡ, cơ tim, biểu mô, gan và thần kinh, góp phần vào quá trình sửa chữa mô và phục hồi chức năng sinh lý.
- Ý nghĩa ứng dụng của hUC-MSCs:
Nhờ sự kết hợp giữa khả năng homing, hoạt tính cận tiết mạnh và tiềm năng biệt hóa đa dòng, hUC-MSCs đã trở thành đối tượng nghiên cứu trọng tâm trong y học tái tạo và phục hồi mô.
- Tác động của MSCs lên quá trình tái tạo cơ xương
- Khả năng tái tạo nội tại của cơ xương:
Cơ xương là mô có tính thích nghi cao và sở hữu khả năng tái tạo nội sinh sau chấn thương hoặc tổn thương di truyền.
- MSCs thúc đẩy sửa chữa và tái tạo cơ:
MSCs đã được chứng minh có tiềm năng thúc đẩy quá trình sửa chữa và tái tạo cả mô cơ và mô xương, trở thành đối tượng nghiên cứu trọng tâm trong điều trị các bệnh lý cơ xương cấp và mạn tính
- Biệt hóa theo dòng cơ (myogenic differentiation):
Trong những điều kiện cảm ứng phù hợp, MSCs có thể biệt hóa thành tế bào cơ, góp phần phục hồi cấu trúc sợi cơ và chức năng co bóp, đặc biệt trong bối cảnh tổn thương hoặc thoái hóa cơ.
- Vai trò paracrine (cận tiết) trong tái tạo cơ:
Bên cạnh biệt hóa trực tiếp, MSCs tiết ra nhiều yếu tố sinh học như yếu tố tăng trưởng, cytokine và các thành phần chất nền ngoại bào, qua đó hỗ trợ quá trình tạo cơ (myogenesis) và tạo mạch (angiogenesis).
- Điều hòa vi môi trường viêm:
Các yếu tố tiết ra từ MSCs giúp điều hòa đáp ứng viêm tại chỗ, tạo môi trường thuận lợi cho quá trình tái tạo và phục hồi mô cơ.
- Cơ chế cận tiết
Vai trò then chốt của tế bào gốc trung mô (MSCs) trong việc thúc đẩy tái tạo và sửa chữa mô chủ yếu được trung gian thông qua cơ chế cận tiết. MSCs tiết ra nhiều phân tử sinh học có hoạt tính, trong đó Sphingosine-1-Phosphate (S1P) được chứng minh có khả năng kích thích tăng sinh nguyên bào cơ, góp phần thúc đẩy tái tạo cơ xương. Bên cạnh các yếu tố hòa tan, các túi ngoại bào (Extracellular Vesicles – Evs) có nguồn gốc từ hUC-MSCs thể hiện tác dụng bảo vệ mô thông qua việc làm giảm stress oxy hóa và ức chế đáp ứng viêm, như đã được ghi nhận trong các mô hình tổn thương thiếu máu–tái tưới máu. Đặc biệt, exosome—một phân nhóm EVs do MSCs tiết ra, đóng vai trò quan trọng trong duy trì cân bằng mô và tái tạo mô cơ xương thông qua việc thúc đẩy tạo mạch và tăng cường các quá trình sinh cơ, từ đó hỗ trợ phục hồi cấu trúc và chức năng cơ.
- Các cơ chế khác
Tế bào gốc trung mô (MSCs) còn thể hiện tác dụng điều trị thông qua các đặc tính chống viêm và điều hòa miễn dịch, gắn liền với khả năng điều hòa stress oxy hóa. Mặc dù các loại oxy phản ứng (ROS) được tạo ra sinh lý trong quá trình chuyển hóa năng lượng và cần thiết cho việc duy trì tăng sinh cũng như chức năng của MSCs, sự sản sinh ROS quá mức sẽ phá vỡ cân bằng oxy hóa – khử và gây tổn thương tế bào. Trước tình trạng này, MSCs kích hoạt các hệ thống chống oxy hóa, bao gồm các enzyme như superoxide dismutase và catalase, cùng với các chất chống oxy hóa không enzyme như glutathione, nhằm trung hòa ROS và giảm stress oxy hóa. Đồng thời, ROS dư thừa có thể hoạt hóa các yếu tố phiên mã nhạy cảm với oxy hóa như HIF-1α và NF-κB, từ đó thúc đẩy phản ứng viêm. Đáng chú ý, sự ổn định của HIF-1α trong MSCs giúp tăng cường hoạt tính điều hòa miễn dịch và tiết các yếu tố tăng trưởng.
Ngoài ra, MSCs còn điều hòa đáp ứng miễn dịch thông qua việc thúc đẩy chuyển đổi đại thực bào từ kiểu hình tiền viêm M1 sang kiểu hình kháng viêm M2, cũng như hỗ trợ sự chuyển biệt của tế bào Th17 sang tế bào T điều hòa, góp phần duy trì cân bằng miễn dịch. Tổng hợp các cơ chế này cho thấy tiềm năng điều trị rộng rãi của MSCs trong các bệnh lý viêm và rối loạn miễn dịch.
Kết luận
Liệu pháp dựa trên tế bào gốc trung mô dây rốn người (hUC-MSCs) cho thấy tiềm năng trở thành một phương án hỗ trợ hoặc thay thế cho CPAP trong điều trị hội chứng ngưng thở khi ngủ do tắc nghẽn (OSAHS). Tổn thương cơ cằm–lưỡi (genioglossus) đóng vai trò then chốt trong cơ chế bệnh sinh và tiến triển của OSAHS. Nhờ các đặc tính chống viêm, chống oxy hóa và tái tạo mô, hUCMSCs có khả năng làm giảm tổn thương genioglossus thông qua nhiều cơ chế phối hợp. Cách tiếp cận điều trị mới nổi này mở ra triển vọng đáng kể trong quản lý OSAHS, tuy nhiên việc ứng dụng lâm sàng vẫn đòi hỏi thêm các nghiên cứu làm rõ cơ chế tác động, đánh giá hiệu quả tiền lâm sàng và thử nghiệm lâm sàng giai đoạn sớm.
Tài liệu tham khảo
- Liu, J. Li, H. Guo, D. Yu, and Y. Liu. (2025). Genioglossus Dysfunction in Obstructive Sleep Apnea Hypopnea Syndrome and the Therapeutic Potential of Human Umbilical Cord Mesenchymal Stem Cells. The FASEB Journal 39, no. 23.
Nguồn: The FASEB Journal
Link: https://faseb.onlinelibrary.wiley.com/action/showCitFormats?doi=10.1096%2Ffj.202502966R