Parent’s Guide to Cord Blood, 1/2025
Medipost là một công ty Hàn Quốc đã phát triển một loạt các sản phẩm liệu pháp tế bào trong đó các tế bào hoạt động là Tế bào gốc trung mô đồng loại (MSC) có nguồn gốc từ máu dây rốn1. Cách tiếp cận này hơi khác thường. Trong mười hai năm đầu tiên (2005-2017) của các thử nghiệm lâm sàng với MSC từ các nguồn chu sinh, hầu hết các thử nghiệm đều lấy tế bào từ mô khi sinh, chỉ có 14% các thử nghiệm sử dụng MSC có nguồn gốc từ máu2. Nhưng Medipost đã sớm áp dụng nền tảng công nghệ của họ và theo đuổi các thử nghiệm lâm sàng đối với các sản phẩm của họ kể từ năm 20093.
Chiến lược Medipost đã mang lại thành quả vào tháng 1 năm 2012 khi sản phẩm Cartistem® của họ được Bộ An toàn Thực phẩm và Dược phẩm Hàn Quốc (MFDS) chấp thuận để điều trị các khiếm khuyết sụn đầu gối do thoái hóa xương khớp hoặc do chấn thương tái phát4. Sự chấp thuận này đã đưa Cartistem® trở thành sản phẩm y học tái tạo đầu tiên được sản xuất từ máu dây rốn đạt được sự chấp thuận ở bất kỳ nơi nào trên thế giới.
Cartistem® được tiêm vào đầu gối bằng phương pháp phẫu thuật với liều mục tiêu là 2,5 x 106 tế bào/500uL/cm2. Cụ thể, Cartistem® được chấp thuận cho các khiếm khuyết sụn cấp độ IV trong đó sụn bị rách và lộ xương dưới sụn5. Trên toàn thế giới, 365 triệu người bị viêm khớp gối vào năm 2019 và con số này trên toàn cầu tiếp tục tăng theo độ tuổi của dân số6,7. Các bác sĩ chỉnh hình sử dụng nhiều chiến lược khác nhau để điều trị các khiếm khuyết sụn gối, trong đó ghép xương sụn dành riêng cho các tổn thương lớn hơn và sâu hơn5,8.Các nghiên cứu không thống nhất chính xác về tỷ lệ mắc các khiếm khuyết sụn cấp độ IV, nhưng khoảng 5-10% số người trên 40 tuổi bị tổn thương sụn cấp độ cao8
Công ty Medipost đã đạt được thành công lớn khi cung cấp Cartistem® cho những bệnh nhân bị thoái hóa khớp gối nặng. Năm 2022, một ấn phẩm về quá trình theo dõi 5 năm đối với những bệnh nhân được điều trị bằng Cartistem® đã nhận được giải thưởng thường niên cho nghiên cứu gốc hay nhất từ tạp chí của Hiệp hội chỉnh hình thể thao Hoa Kỳ (AOSSM)9. Đến tháng 6 năm 2024, số lượng bệnh nhân được điều trị bằng Cartistem® đã vượt quá 30.00010. Tạp chí Korea Biomedical Review báo cáo rằng “Doanh số bán Cartistem đã tăng trưởng với tốc độ hàng năm là 36 phần trăm cho đến năm 2023, trở thành liệu pháp tế bào gốc đầu tiên của Hàn Quốc vượt quá 20 tỷ won (14,4 triệu đô la) doanh số hàng năm”10.
Medipost là một công ty trị liệu tế bào toàn diện với các hoạt động từ ngân hàng sinh học đến nghiên cứu và phát triển lâm sàng. Medipost điều hành một trong những ngân hàng máu cuống rốn lớn nhất tại Hàn Quốc, dưới tên thương hiệu CellTree. Tính đến tháng 10 năm 2024, hàng tồn kho ròng của họ là 319 nghìn đơn vị máu dây rốn và họ đã phân phối cho 563 ca ghép (468 ca không liên quan)11.
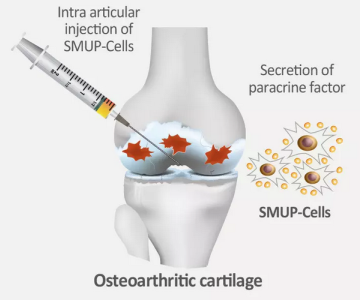
Medipost đang tìm cách mở rộng thị trường bằng cách xin phê duyệt Cartistem® cho các chỉ định chỉnh hình bổ sung. Vào tháng 12 năm 2024, các cơ quan quản lý của Hàn Quốc đã từ chối yêu cầu phê duyệt Cartistem® để điều trị sụn khớp cổ chân và các khuyết tật xương sụn12. Kết luận là dữ liệu thử nghiệm giai đoạn 2 cho thấy hiệu quả lâm sàng của Cartistem® cho chỉ định này là không đủ mạnh. Medipost có ý định thử lại với thử nghiệm giai đoạn 312. Trong lúc đó, Medipost cũng đã phát triển phiên bản Cartistem® thế hệ thứ hai, hiện được gọi là SMUP-1A-01, kết hợp phương pháp chọn lọc tế bào nhỏ (SM) với phương pháp nuôi cấy độc quyền của họ để tạo ra liệu pháp tế bào cực mạnh (UP)13. Theo Medipost, phiên bản MSC có nguồn gốc từ máu cuống rốn thế hệ thứ hai này có thể được sản xuất với hiệu quả cao hơn và chi phí thấp hơn. Sản phẩm SMUP-1A-01 đang trong giai đoạn thử nghiệm lâm sàng giai đoạn 2 tại Hàn Quốc, sử dụng phương pháp tiêm nội khớp để điều trị và ngăn ngừa tổn thương do viêm xương khớp13.
Medipost cũng đang tìm cách mở rộng thị trường bằng cách tận dụng thành công của họ tại Hàn Quốc để có được sự chấp thuận của thị trường tại các quốc gia khác. Medipost hiện đang tiến hành các thử nghiệm lâm sàng để có được sự chấp thuận cho Cartistem® như một liệu pháp điều trị đầu gối tại Nhật Bản và Bắc Mỹ.
Tại Nhật Bản, Medipost đã triển khai thử nghiệm lâm sàng giai đoạn 2 vào tháng 12 năm 2019 nhằm đánh giá hiệu quả của Cartistem® kết hợp với High Tibial Osteotomy (HTO). Tuy nhiên, đại dịch do virus Corona đã cản trở việc đăng kí thử nghiệm đó. Vào tháng 2 năm 2024, Medipost đã nhận được sự cho phép từ Cơ quan Dược phẩm và Thiết bị Y tế Nhật Bản (PMDA) để rút thử nghiệm giai đoạn 2 và thay vào đó tập trung vào thử nghiệm giai đoạn 3 chỉ riêng Cartistem®14. Thử nghiệm giai đoạn 3 đã đạt được 90% số lượng ghi danh vào tháng 6 năm 202410. Cartistem® được sản xuất tại Nhật Bản bởi công ty Evastem, một công ty hợp tác giữa Medipost và Công ty Dược phẩm Nhật Bản VICX therapists15.
Tại Canada, Medipost đã đầu tư 90 triệu đô la Canada vào tháng 5 năm 2022 để hợp tác với OmniaBio Inc., một công ty con của Trung tâm Thương mại hóa Y học Tái tạo (CCRM) của Canada16. Medipost và OmniaBio đã cùng nhau xây dựng một tổ chức sản xuất và phát triển theo hợp đồng (CDMO) mới tại Hamilton, Ontario, Canada17.Theo báo cáo của Business Korea, “OmniaBio hiện tự hào có không gian sản xuất là 11.200 m2,trở thành công ty CDMO chuyên biệt lớn nhất về liệu pháp tế bào và gen tại Canada”17. Cùng lúc đó, Medipost đã hoàn thành thử nghiệm lâm sàng giai đoạn 1/2 của Cartistem® tại Hoa Kỳ10. Họ đang bỏ qua giai đoạn 2 và đang chuẩn bị đơn xin Thuốc mới đang nghiên cứu (IND) cho thử nghiệm lâm sàng giai đoạn 3, với việc sản xuất sản phẩm do OmniaBio thực hiện10,17. Mục tiêu cuối cùng của Medipost là đạt được sự chấp thuận của FDA Hoa Kỳ cho Cartistem®. Với mục tiêu đó, Medipost gần đây đã thuê một nhóm điều hành để quản lý các hoạt động tại Bắc Mỹ18.
Trong bài báo về sự thành công của Cartistem® không thể thiếu tốc độ tương đối của các phê duyệt sản phẩm liệu pháp tế bào ở phương Đông so với phương Tây. Cartistem® là một trong những liệu pháp tế bào được sản xuất bằng cách phân lập và tăng sinh các tế bào cụ thể có nguồn gốc từ máu dây rốn3. Trong khi Cartistem® được phê duyệt tại Hàn Quốc vào tháng 1 năm 2012, thì phải mất 11 năm, cho đến tháng 4 năm 2023, trước khi có phê duyệt thứ hai cho một sản phẩm máu dây rốn mở rộng. Phê duyệt thứ hai diễn ra khi FDA Hoa Kỳ phê duyệt Omisirge (trước đây gọi là Omidubicel và trước đó là NiCord) từ Gamida Cell19. Trong khi Cartistem® mất ba năm thử nghiệm lâm sàng để được phê duyệt tại Hàn Quốc, Omisirge đã trải qua các thử nghiệm đa quốc gia trong 16 năm (từ năm 2007) trước khi được phê duyệt3,19. Phải thừa nhận rằng Cartistem® là liệu pháp y học tái tạo cho tình trạng viêm khớp phổ biến, trong khi Omisirge được thiết kế để đẩy nhanh quá trình ghép máu dây rốn, và do đó các thử nghiệm của Omisirge liên quan đến những bệnh nhân ốm yếu hơn và có quá trình tích lũy chậm hơn. Việc chấp thuận Omisirge đến quá muộn để ngăn chặn sự phá sản của Gamida Cell vào năm 202420. Người ta tự hỏi liệu bệnh nhân ngày nay có được tiếp cận thường xuyên với các ca ghép máu dây rốn mở rộng hay không nếu Omisirge và các sản phẩm tương tự khác được đưa ra thị trường đầu tiên ở một quốc gia châu Á. Nhờ sự tiếp nhận nhanh chóng của Cartistem® tại Hàn Quốc, công ty đang ở vị thế thuận lợi để nhận được sự chấp thuận sản phẩm ở các quốc gia khác, do đó trong tương lai gần, những người bị viêm khớp gối nặng có thể tiếp cận với liệu pháp sinh học có nguồn gốc từ máu dây rốn.
Tài liệu tham khảo
- Products. First-Generation of Stem Cell Products.
- Verter F, Silva Couto P, Bersenev A. A Dozen Years of Clinical Trials Performing Advanced Cell Therapy with Perinatal Cells. Future Science 2018; 4(10):FSO351.
- Verter F, Bersenev A, Silva Couto P. Clinical Trials of Expanded Cord Blood. Parent’s Guide to Cord Blood Foundation Newsletter Published 2018-05
- South Korea Ministry of Food & Drug Safety. Biological Products. CARTISTEM® Last updated 2016-03-24
- International Cartilage Repair Society (ICRS). Cartilage Repair Techniques. Accessed 2024-12-31
- World Health Organization (WHO). Osteoarthritis. Published 2023-07-14
- GBD 2021 Osteoarthritis Collaborators. Global, regional, and national burden of osteoarthritis, 1990–2020 and projections to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Rhematology 2023; 5(9):e508-e522.
- Watts E, McCulloch PC. Articular Cartilage Defects of Knee. Ortho Bullets. Last updated 2024-12-06
- MEDIPOST’s 5-year follow-up of phase 3 clinical trial patients receives 2021 OJSM award. Stem Cell Therapeutic. Press Release. Published 2022-07-18
- Kim C-H. Number of patients getting Cartistem tops 30,000: Medipost. Korea Biomedical Review. Published 2024-06-24
- Business. CELLTREE®.
- Sung JJ. Medipost’s ‘Cartistem’ ankle treatment additional indication rejected by Ministry of Food and Drug Safety, plans to re-challenge for Phase 3 clinical trial. THE BIO. Published 2024-12-26
- Products.Second-Generation of Stem Cell Products.
- Kim C-H. Medipost withdraws Japanese p2 trial for stem cell therapy. Korea Biomedical Review. Published 2024-02-05
- Lee H-S. Japan OKs Medipost’s P2 trial of stem cell-serviced osteoarthritis treatment. Korea Biomedical Review. Published 2019-12-09
- OmniaBio Inc. announces private investor. Press Release. Published 2022-05-31
- Choi M-H. Medipost’s OmniaBio Launches Largest CGT CDMO Facility in Canada. Business Korea. Published 2024-10-21
- MEDIPOST, Inc. Expands U.S. Presence with Key Executive Appointments, advances toward Phase III clinical trial of CARTISTEM® in North America. Press Release. Published 2024-12-03
- Verter F. 1st FDA Approval Omisirge Expanded Cord Blood. Parent’s Guide to Cord Blood Foundation Newsletter Published 2023-05
- Cooley LLP. Gamida Cell Completes International Restructuring. Press Release. Published 2024-06-21
Nguồn: Parent’s Guide to Cord Blood
Link: https://parentsguidecordblood.org/en/news/cartistem-cord-blood-derived-therapy-knee-arthritis