Frontiers in Immunology, 19/12/2025
Giới thiệu
Viêm đóng vai trò trung tâm trong sinh bệnh học của nhiều bệnh lý cấp và mạn tính, từ bệnh tự miễn, thoái hóa đến tổn thương mô do thiếu máu – tái tưới máu. Mặc dù các liệu pháp kháng viêm truyền thống giúp kiểm soát triệu chứng, chúng thường không giải quyết được rối loạn miễn dịch nền tảng và tiềm ẩn nhiều tác dụng phụ khi sử dụng kéo dài. Do đó, nhu cầu về các chiến lược điều trị mới, có khả năng điều hòa miễn dịch một cách toàn diện và bền vững, ngày càng trở nên cấp thiết.
Tế bào gốc trung mô từ dây rốn (UC-MSCs) nổi lên như một ứng viên đầy hứa hẹn nhờ khả năng điều hòa miễn dịch mạnh, tính sinh miễn dịch thấp và nguồn thu nhận dồi dào, không xâm lấn. UC-MSCs có thể tác động lên nhiều thành phần của đáp ứng viêm thông qua tiếp xúc tế bào – tế bào và tiết các yếu tố hòa tan, từ đó ức chế phản ứng viêm quá mức và thúc đẩy sửa chữa mô.
Trong những năm gần đây, ngày càng nhiều nghiên cứu tiền lâm sàng và lâm sàng đã chứng minh tiềm năng của UC-MSCs trong điều trị các bệnh liên quan đến viêm. Bài tổng quan này tập trung phân tích cơ chế điều hòa viêm của UC-MSCs, các bằng chứng lâm sàng hiện có, cũng như định hướng phát triển trong tương lai nhằm tối ưu hóa hiệu quả và thúc đẩy ứng dụng lâm sàng của liệu pháp này.
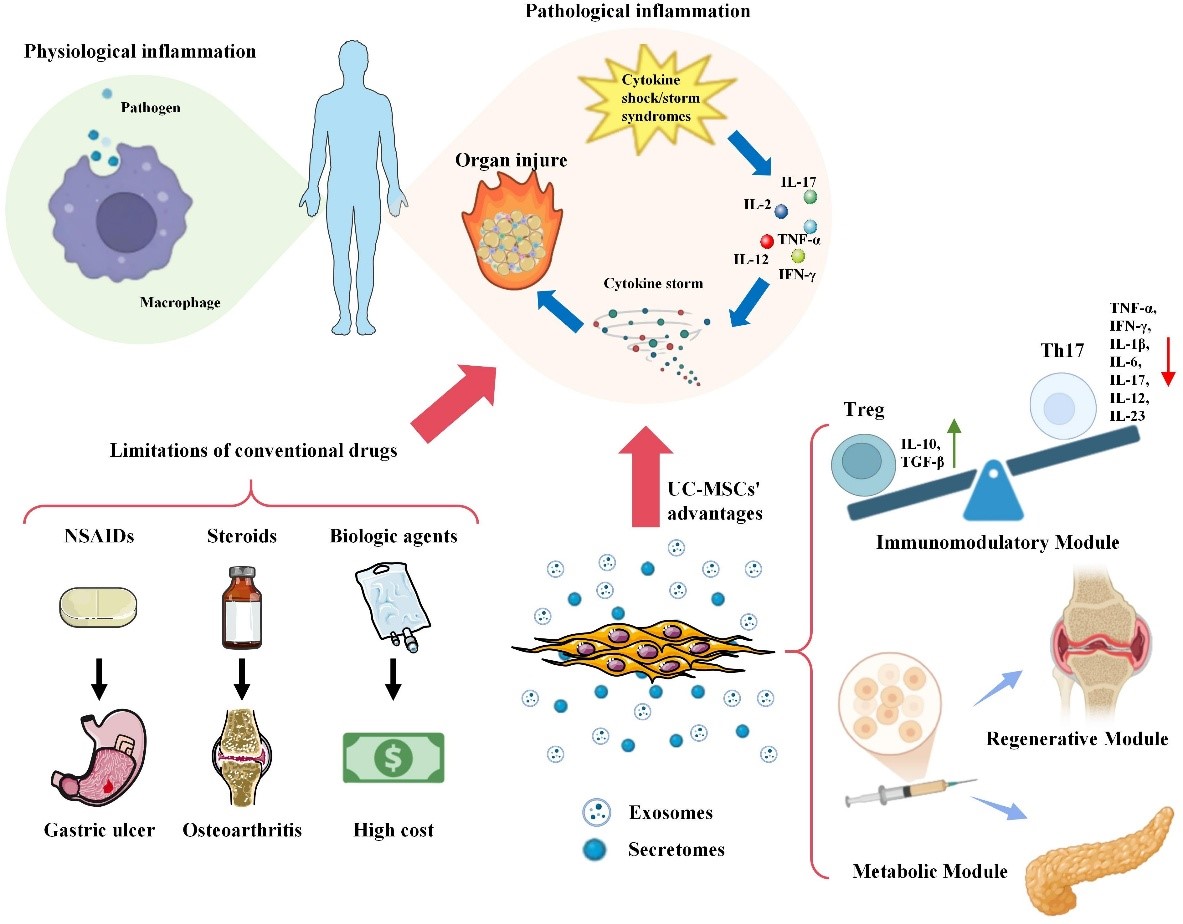
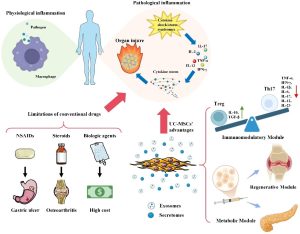
Hình 1. UC-MSCs khắc phục các hạn chế của liệu pháp kháng viêm truyền thống thông qua cơ chế đa mô-đun. Các thuốc thông thường như NSAIDs, corticosteroid và sinh phẩm sinh học bị giới hạn bởi tác dụng phụ, chi phí cao và nguy cơ kháng thuốc. Ngược lại, tế bào gốc trung mô có nguồn gốc từ dây rốn người (UC-MSCs) tạo ra một sự thay đổi mô hình điều trị thông qua ba mô-đun chính: điều hòa miễn dịch.
Cơ chế mô-đun điều hòa viêm của UC-MSCs
Hiệu quả điều trị của UC-MSCs trong điều hòa viêm không xuất phát từ một con đường phân tử đơn lẻ, mà được tạo nên bởi cơ chế mô-đun hiệp đồng có tính thích nghi cao. Dưới tác động của các tín hiệu vi môi trường viêm, UC-MSCs có khả năng linh hoạt kích hoạt các mô-đun chức năng tương đối độc lập nhưng có mối liên hệ chặt chẽ, bao gồm tái lập trình tế bào miễn dịch, ức chế inflammasome và truyền thông gian bào. Cơ chế này cho phép UC-MSCs thực hiện điều hòa miễn dịch chính xác, phụ thuộc bối cảnh bệnh lý, đồng thời thúc đẩy sửa chữa và tái tạo mô.
- Mô-đun tái lập trình tế bào miễn dịch
UC-MSCs điều hòa cả miễn dịch thích ứng và bẩm sinh thông qua cơ chế phụ thuộc bối cảnh viêm. Ở miễn dịch thích ứng, UC-MSCs ức chế hoạt hóa tế bào T, thúc đẩy Treg và tái lập cân bằng Th17/Treg thông qua IL-10, TGF-β và các trục điều hòa tín hiệu–miRNA, góp phần cải thiện các bệnh tự miễn và GVHD. Ở miễn dịch bẩm sinh, UC-MSCs và exosome của chúng điều khiển phân cực đại thực bào và microglia theo hướng kháng viêm thông qua điều hòa chuyển hóa–biểu sinh. Nhờ khả năng đáp ứng linh hoạt với môi trường viêm, UC-MSCs hoạt động như một điểm kiểm soát miễn dịch–chuyển hóa động, khác biệt với các điểm kiểm soát miễn dịch cổ điển.
- Mô-đun ức chế inflammasome (phức hợp protein cảm ứng viêm nội bào)
UC-MSCs ức chế phản ứng viêm phụ thuộc inflammasome, đặc biệt là NLRP3, thông qua nhiều cơ chế phối hợp. UC-MSCs và exosome của chúng ngăn cản sự lắp ráp và hoạt hóa NLRP3, đồng thời điều hòa chuyển hóa miễn dịch của đại thực bào theo hướng kháng viêm, làm giảm tiết cytokine tiền viêm. Bên cạnh đó, UC-MSCs duy trì kiểm soát chất lượng ty thể, hạn chế giải phóng mitoDAMPs và ức chế hoạt hóa caspase-1, từ đó làm gián đoạn chuỗi tín hiệu viêm nội bào. Tùy theo bối cảnh bệnh lý, UC-MSCs còn phối hợp với các trục tín hiệu đặc hiệu để tăng cường tác dụng kháng viêm và chống oxy hóa. Các bằng chứng thực nghiệm, bao gồm mô hình nuôi cấy 3D và exosome, cho thấy mô-đun này đóng vai trò trung tâm trong kiểm soát viêm và thoái hóa mô.
- Mô-đun truyền thông gian bào
UC-MSCs điều hòa viêm và tái tạo mô chủ yếu thông qua truyền thông gian bào, bao gồm tín hiệu cận tiết và tiếp xúc trực tiếp. Thông qua exosome, UC-MSCs vận chuyển các phân tử hoạt tính sinh học giúp thúc đẩy sửa chữa mô, tái cấu trúc chất nền ngoại bào và tân sinh mạch. Ngoài ra, UC-MSCs còn truyền trực tiếp bào quan, đặc biệt là ty thể, sang tế bào tổn thương thông qua tunneling nanotubes (TNTs), góp phần phục hồi chuyển hóa năng lượng và chức năng tế bào đích. Hiệu quả của mô-đun này có thể được tăng cường bằng các chiến lược kỹ thuật như nuôi cấy 3D, sử dụng giàn giáo sinh học và tinh sạch hoặc thiết kế exosome nhằm nâng cao tính đặc hiệu và hiệu quả điều hòa miễn dịch. Các bằng chứng tiền lâm sàng cho thấy mô-đun truyền thông gian bào đóng vai trò quan trọng trong cải thiện tổn thương mô và có tiềm năng chuyển giao lâm sàng rõ rệt.
Nghiên cứu lâm sàng về UC-MSCs trong các bệnh lý liên quan đến viêm
Các nghiên cứu tiền lâm sàng đã chứng minh độ an toàn thuận lợi và hiệu quả điều trị đáng kể của UC-MSCs, đồng thời nhiều thử nghiệm lâm sàng đang được triển khai nhằm đánh giá tiềm năng ứng dụng của chúng trong điều trị các bệnh lý viêm. Cơ sở dữ liệu ClinicalTrials.gov của Viện Y tế Quốc gia Hoa Kỳ ghi nhận gần 100 thử nghiệm lâm sàng trên toàn cầu nghiên cứu việc sử dụng UC-MSCs trong các bệnh viêm. Phân tích theo khu vực địa lý cho thấy hoạt động nghiên cứu tập trung chủ yếu tại Trung Quốc, Liên minh Châu Âu và Hoa Kỳ. Tuy nhiên, 82,2% các nghiên cứu vẫn đang ở giai đoạn I và II, trong khi chỉ 5,6% tiến tới giai đoạn III và IV. Mặc dù các dữ liệu ban đầu ủng hộ tính an toàn của UC-MSCs, những vấn đề then chốt như liều dùng tối ưu, đường sử dụng và hiệu quả điều trị dài hạn vẫn cần được đánh giá một cách hệ thống và toàn diện.
- Bệnh viêm ruột (Inflammatory bowel disease, IBD)
IBD, bao gồm viêm loét đại tràng và bệnh Crohn, là bệnh viêm mạn tính đường tiêu hóa. Các nghiên cứu lâm sàng cho thấy UC-MSCs an toàn và hiệu quả trong điều trị IBD thông qua đường truyền tĩnh mạch hoặc tiêm tại chỗ. Ở bệnh nhân Crohn phụ thuộc corticosteroid, truyền UC-MSCs (4 liều, 1 × 10⁶ tế bào/kg) giúp giảm đáng kể mức độ bệnh (CDAI, HBI) và giảm liều corticosteroid so với nhóm chứng, với tác dụng phụ nhẹ và thoáng qua. Trong viêm loét đại tràng nặng, UC-MSCs cải thiện rõ rệt tổn thương niêm mạc, làm giảm điểm Mayo và điểm mô học, đồng thời nâng cao chất lượng sống, mà không ghi nhận biến cố bất lợi nghiêm trọng. Tổng thể, UC-MSCs là lựa chọn điều trị tiềm năng, an toàn và hiệu quả cho IBD kháng hoặc đáp ứng kém với điều trị chuẩn.
- Xơ gan
Xơ gan là hậu quả của viêm và xơ hóa gan mạn tính do nhiều nguyên nhân. Các nghiên cứu cho thấy liệu pháp MSCs, đặc biệt là UC-MSCs, an toàn và hiệu quả trong điều trị xơ gan và suy gan tiến triển. UC-MSCs giúp cải thiện chức năng gan, giảm viêm, điều hòa miễn dịch (giảm IL-6, TNF-α; tăng IL-10, Treg), giảm tỷ lệ suy gan và cải thiện sống còn, với rất ít tác dụng phụ nghiêm trọng.
- COVID-19
COVID-19 nặng liên quan đến phản ứng viêm quá mức và bão cytokine. Nhiều thử nghiệm lâm sàng cho thấy UC-MSCs an toàn và có hiệu quả trong điều trị COVID-19 nặng/ARDS, giúp giảm viêm (IL-6, TNF-α, CRP), cải thiện oxy hóa phổi, giảm tổn thương phổi trên CT và tăng tỷ lệ sống. UC-MSCs còn hỗ trợ phục hồi cấu trúc phổi dài hạn, với không ghi nhận biến cố bất lợi nghiêm trọng. Tuy nhiên, cần thêm nghiên cứu để tối ưu thời điểm can thiệp, liều dùng và phác đồ điều trị.
- Thoái hóa khớp (OA)
Thoái hóa khớp (OA) là bệnh mạn tính, hiện chưa có thuốc điều trị hiệu quả lâu dài. UC-MSCs nhờ khả năng tăng sinh, di cư và điều hòa viêm có tiềm năng thúc đẩy tái tạo sụn. Một thử nghiệm lâm sàng pha I/II cho thấy tiêm nội khớp UC-MSCs (đặc biệt phác đồ tiêm lặp lại) an toàn, cải thiện đau đáng kể và cải thiện chức năng khớp so với dùng acid hyaluronic trong 12 tháng theo dõi, không ghi nhận tác dụng phụ nghiêm trọng, dù không thấy khác biệt rõ trên MRI.
- Graft-versus-host disease (GVHD)
GVHD là biến chứng nặng sau ghép tế bào gốc tạo máu dị sinh, với tỷ lệ aGVHD khoảng 40% và ảnh hưởng nghiêm trọng đến tiên lượng dài hạn. UC-MSCs thể hiện hiệu quả rõ rệt trong điều trị và dự phòng GVHD nhờ khả năng điều hòa miễn dịch mạnh. Các nghiên cứu lâm sàng cho thấy UC-MSCs đạt tỷ lệ đáp ứng 59–63% ở aGVHD kháng steroid, hiệu quả tốt hơn ở trẻ em và GVHD mức độ nhẹ, đồng thời cải thiện sống còn. Trong dự phòng, UC-MSCs giúp giảm đáng kể tỷ lệ aGVHD và cGVHD mà không làm tăng nguy cơ tái phát bạch cầu. Cơ chế chính bao gồm tái lập cân bằng miễn dịch, huy động MDSCs, và điều hòa viêm qua exosome/miRNA. Tổng thể, UC-MSCs được chứng minh an toàn và có lợi ích đa chiều trong quản lý GVHD.
- Lupus ban đỏ
Lupus ban đỏ hệ thống (SLE) là dạng lupus phổ biến và nặng nhất, tổn thương đa cơ quan và khó điều trị. UC-MSCs cho thấy hiệu quả điều hòa miễn dịch rõ rệt trong SLE, đặc biệt thông qua ức chế tế bào B (CD19⁺) và điều hòa hoạt hóa tế bào T, với tác dụng vượt trội so với exosome đơn thuần. Các nghiên cứu theo dõi dài hạn chứng minh tính an toàn và hiệu quả bền vững, với tỷ lệ sống sau 5 năm đạt 84% và 34% bệnh nhân đạt lui bệnh, kèm cải thiện chỉ số hoạt động bệnh và các marker huyết thanh. Những dữ liệu này ủng hộ UC-MSCs là hướng điều trị tiềm năng cho SLE kháng trị.
- Viêm khớp dạng thấp (RA)
Viêm khớp dạng thấp là bệnh viêm mạn tính gây tàn phế cao, trong đó UC-MSCs thể hiện tác dụng điều hòa miễn dịch mạnh bằng cách ức chế tế bào T, B, DC và NK, từ đó giảm phản ứng viêm. Thử nghiệm lâm sàng pha I/II ở bệnh nhân RA kháng trị cho thấy UC-MSCs an toàn lâu dài (theo dõi 1–3 năm) và giúp giảm rõ rệt các dấu chỉ viêm (ESR, CRP, RF, anti-CCP) cũng như cải thiện chức năng khớp (DAS28, HAQ), chứng minh hiệu quả điều trị tiềm năng.
- Viêm cột sống dính khớp (AS)
Viêm cột sống dính khớp là bệnh viêm mạn gây đau, cứng và hạn chế vận động cột sống, liên quan đến rối loạn miễn dịch (giảm Treg). Các nghiên cứu lâm sàng bước đầu cho thấy truyền tĩnh mạch UC-MSCs an toàn, chỉ gây sốt nhẹ thoáng qua, và giảm hoạt tính bệnh cũng như cải thiện chức năng (giảm BASDAI, BASFI, đau; hạ ESR, CRP, TNF-α, ICAM). Phân tích gộp cho thấy hiệu quả tổng thể cao hơn so với điều trị thông thường. Ngoài ra, UC-MSCs kết hợp scaffold HA hỗ trợ tạo xương và cải thiện chất lượng sống trong các tổn thương đốt sống. Tuy nhiên, cần nghiên cứu quy mô lớn hơn để khẳng định hiệu quả.
- Viêm mũi dị ứng
Viêm mũi dị ứng là bệnh hô hấp phổ biến do quá mẫn type I qua trung gian IgE, đặc trưng bởi mất cân bằng miễn dịch Th1/Th2, tăng Th2, dưỡng bào và eosinophil. UC-MSCs nhờ khả năng điều hòa miễn dịch và tính sinh miễn dịch thấp có thể di chuyển đến niêm mạc mũi, giúp khôi phục cân bằng Th1/Th2 và tăng Treg, từ đó cải thiện triệu chứng. Hiện có thử nghiệm lâm sàng giai đoạn sớm đang đánh giá tính khả thi, độ an toàn và liều dùng của UC-MSCs truyền tĩnh mạch trong điều trị AR, làm cơ sở cho các nghiên cứu lâm sàng tiếp theo.
Các nghiên cứu lâm sàng cho thấy UC-MSCs có hiệu quả và độ an toàn nhất quán trên nhiều bệnh lý viêm. Tác dụng phụ thường gặp nhất là sốt thoáng qua, tự hồi phục; không ghi nhận biến chứng nghiêm trọng hay di chứng lâu dài. UC-MSCs giúp cải thiện rõ rệt các chỉ số hoạt tính bệnh (CDAI trong Crohn, SLEDAI trong lupus, DAS28 trong RA) và tăng sống còn ở các bệnh nặng như COVID-19 và GVHD. Phác đồ truyền lặp lại (2–4 lần) thường cho hiệu quả bền vững hơn, đặc biệt ở bệnh mạn và nặng (GVHD, xơ gan). Đường tĩnh mạch và tại chỗ đều dung nạp tốt, phù hợp cho bệnh toàn thân và khu trú. Tổng thể, UC-MSCs thể hiện tính đa chức năng và cơ chế điều hòa miễn dịch – sửa chữa mô mang tính mô-đun trên phổ bệnh rộng.
Đánh giá hiệu quả lâm sàng và tối ưu hóa phác đồ điều trị
Do đặc tính sinh học phong phú và tiềm năng ứng dụng lâm sàng rộng lớn của UC-MSCs, các nghiên cứu lâm sàng liên quan đang không ngừng được triển khai. Nhiều bằng chứng cho thấy đường dùng và liều lượng UC-MSCs là những yếu tố then chốt ảnh hưởng trực tiếp đến hiệu quả điều trị. Dựa trên các tài liệu nghiên cứu lâm sàng hiện có, bài tổng quan này tóm lược các đường truyền và liều truyền UC-MSCs thường được sử dụng, nhằm làm cơ sở cho việc đánh giá hiệu quả điều trị và tối ưu hóa phác đồ trong thực hành lâm sàng.
- Phân tích mối tương quan giữa hoạt tính các mô-đun chức năng và hiệu quả lâm sàng
Hiệu quả điều trị của UC-MSCs trong các bệnh viêm phụ thuộc chặt chẽ vào hoạt tính các mô-đun chức năng, trong đó khả năng tiết cytokine kháng viêm, đặc biệt là IL-10, đóng vai trò là dấu chỉ then chốt. Nhiều phân tích cho thấy mức IL-10 tương quan mạnh với cải thiện lâm sàng (ví dụ giảm điểm Mayo ở viêm ruột), khẳng định vai trò trung tâm của mô-đun điều hòa miễn dịch.
Bên cạnh đó, liều lượng và tần suất sử dụng là yếu tố quyết định hiệu quả điều trị. Các phác đồ truyền tĩnh mạch với liều và lịch dùng khác nhau nhìn chung đều ghi nhận cải thiện lâm sàng rõ rệt và độ an toàn cao, với tác dụng phụ thường gặp nhất là sốt nhẹ thoáng qua. Các đường dùng khác như tiêm nội khớp (20×10⁶ tế bào trong thoái hóa khớp) hay tiêm nội tủy (1×10⁶ tế bào/kg mỗi tuần × 4 lần) cũng cho thấy hiệu quả cải thiện triệu chứng, với tác dụng phụ chủ yếu nhẹ và tạm thời.
Nhìn chung, các dữ liệu lâm sàng cho thấy mối quan hệ liều – đáp ứng rõ ràng, nhấn mạnh rằng việc hiểu sâu sự liên kết giữa hoạt tính mô-đun chức năng của UC-MSCs (định hướng mô tổn thương, điều hòa miễn dịch, sửa chữa mô) và hiệu quả lâm sàng là cơ sở quan trọng để xây dựng các chiến lược điều trị an toàn, hiệu quả và cá thể hóa.
- Mô hình dược động học tế bào sống và tối ưu hóa phác đồ điều trị
Tối ưu hóa điều trị bằng UC-MSCs đòi hỏi xây dựng chiến lược liều dựa trên mô hình dược động học của tế bào sống, gồm 3 giai đoạn: đưa liều – phân bố – thải trừ. Mô hình này giúp dự đoán động học hoạt tính UC-MSCs theo thời gian, từ đó xác định đường dùng, liều, tần suất và khoảng cách truyền tối ưu.
- Bằng chứng lâm sàng:
- Phòng ngừa GVHD: liều ~1×10⁶ tế bào/kg mỗi tuần cho hiệu quả điều hòa miễn dịch bền vững.
- Tổn thương tủy sống (tiêm nội tủy): đa liều (1×10⁶ tế bào/kg/tuần × 4) cho hiệu quả cao hơn rõ rệt so với liều đơn; tác dụng phụ nhẹ và thoáng qua.
→ Khẳng định cần duy trì hoạt tính tế bào bằng truyền lặp lại.
- Tối ưu khoảng liều & thời gian điều trị: Giảm nguy cơ đáp ứng miễn dịch, đồng thời tăng hiệu quả; hỗ trợ cá thể hóa phác đồ.
- Thuật toán liều dựa biomarker: Đề xuất quan hệ Dose = k × ln(IL-6) + C, phản ánh lợi ích giảm dần khi IL-6 cao; UC-MSCs đã được chứng minh làm giảm IL-6, qua đó cải thiện đáp ứng điều trị.
- Liều–đáp ứng:
- Liều cao cho hiệu quả điều hòa miễn dịch mạnh hơn (tình nguyện viên khỏe mạnh).
- Xơ gan (tiêm động mạch gan): 4×10⁸ tế bào, 2 lần giảm suy gan, an toàn tốt.
Phác đồ tối ưu cần tích hợp dược động học UC-MSCs + biomarker viêm (như IL-6) + đặc điểm cá thể bệnh nhân. Các thử nghiệm đang diễn ra sẽ tiếp tục tinh chỉnh chiến lược định liều chính xác cho các bệnh viêm.
Định hướng tương lai và các mô hình điều trị mới nổi
Mặc dù UC-MSCs tiềm năng trong điều trị bệnh viêm, ứng dụng lâm sàng còn nhiều thách thức, đòi hỏi tập trung vào tối ưu hóa tế bào và cá thể hóa điều trị.
- Tăng cường UC-MSCs: Chỉnh sửa gen (CRISPRa) để tăng IL-10, PD-L1; nuôi cấy 3D và bioreactor “huấn luyện” tế bào trong môi trường viêm, nâng cao hiệu quả sau truyền.
- Exosome UC-MSCs (MSC-Exos): Chiến lược thế hệ mới, an toàn, ít miễn dịch, dược động học kiểm soát, dễ chuẩn hóa. Chứa miRNA, cytokine, protein chức năng, hiệu quả tương đương MSCs, giảm rủi ro u hóa và thải ghép; có thể kỹ thuật hóa để nhắm đích và giải phóng thuốc theo nhu cầu.
- Y học chính xác dựa trên biomarker: Dự đoán đáp ứng dựa trên IL-6, TNF-α, tỷ lệ Th17/Treg và học máy; chuẩn hóa chất lượng tế bào dựa trên chức năng (IL-10, exosome) thay vì marker bề mặt.
- Chuẩn hóa và quản lý dài hạn: Tiêu chuẩn toàn cầu từ chọn người hiến, nuôi cấy, bảo quản đến phục hồi tế bào; tối ưu thời điểm, đường dùng, liều cá thể hóa; cần hệ thống theo dõi dài hạn và khung pháp lý cho UC-MSCs và MSC-Exos.
UC-MSCs và dẫn xuất đại diện cho mô hình điều trị đa chức năng, mô-đun. Thành công tương lai dựa trên ba chuyển dịch: từ tự nhiên → kỹ thuật hóa, từ kinh nghiệm → y học chính xác, từ nghiên cứu thăm dò → thực hành chuẩn hóa.
Tài liệu tham khảo
Yin, Li & Sun, Chen-yang & Chen, Gui-lai & Xiang, Zhuo & Hu, Bao-quan & Zhou, Fang & Wang, Qiang. (2025). Modular mastery of inflammation: umbilical cord mesenchymal stem cells as a therapeutic frontier. Frontiers in Immunology. 16. 10.3389/fimmu.2025.1721947.
Nguồn: Frontiers in Immunology
Link: https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2025.1721947/full