European Journal of Gastroenterology & Hepatology, 2018
Bin Chen, Yong-Hong Wang, Jin-Qin Qian, et al
Giới thiệu
Suy gan cấp tính trên nền mãn tính (ACLF) xảy ra ở những bệnh nhân mắc bệnh gan mãn tính, được đặc trưng bởi tổn thương gan cấp tính như vàng da và rối loạn đông máu [1]. Tỷ lệ tử vong sau 3 tháng đối với những bệnh nhân này chủ yếu là do suy đa cơ quan và nhiễm trùng nặng [2–4]. Ở châu Á, ACLF chủ yếu do nhiễm vi rút viêm gan B (HBV) và tỷ lệ tử vong cao tới 63–72,3% [5,6].
Hiện nay, ghép gan là liệu pháp duy nhất đã được chứng minh là có lợi. Tuy nhiên, bệnh tiến triển nhanh và thiếu người hiến tặng đã hạn chế ứng dụng của nó ở những bệnh nhân nhiễm HBV-ACLF và một nghiên cứu đoàn hệ gần đây của Bỉ đã báo cáo rằng chỉ có 7% bệnh nhân ACLF được điều trị bằng ghép gan [7]. Do đó, các chiến lược mới cho những bệnh nhân này là rất cần thiết.
Tế bào gốc trung mô (MSC) là các tế bào đa năng có khả năng biệt hóa thành nhiều loại tế bào khác nhau, bao gồm cả tế bào gan [8,9]. Các nghiên cứu đã chỉ ra rằng việc điều trị bằng MSC có thể cải thiện tình trạng xơ gan [10,11] và đảo ngược tình trạng suy gan tối cấp ở chuột thí nghiệm [12]. Năm 2012, Shi et al. [13] cho thấy rằng ghép MSC có nguồn gốc từ dây rốn (UC-MSC) có thể cải thiện chức năng gan và tăng tỷ lệ sống sót mà không làm tăng tác dụng phụ liên quan đến điều trị. Ngoài ra, họ gợi ý rằng điều trị UC-MSC là an toàn trong phòng khám và có thể phục vụ như một phương pháp điều trị mới cho bệnh nhân ACLF liên quan đến HBV. Bài tổng quan hiện tại và phân tích tổng hợp nhằm mục đích đánh giá một cách có hệ thống hiệu quả và độ an toàn của điều trị MSC ở những bệnh nhân mắc ACLF liên quan đến HBV.
Vật liệu và phương pháp
Chiến lược tìm kiếm và lựa chọn nghiên cứu
Chúng tôi đã thực hiện tìm kiếm tài liệu có hệ thống về ba cơ sở dữ liệu: PubMed (bao gồm MEDLINE) và Embase.com. Thư mục của các bài báo đánh giá có liên quan và tất cả các nghiên cứu bao gồm đã được xem xét thủ công để xác định các nghiên cứu có liên quan. Không có giới hạn nào được áp dụng cho ngôn ngữ hoặc ngày xuất bản vì số lượng bản thảo có hạn.
Tiêu chí bao gồm và loại trừ
Tất cả các bản ghi được xác định thông qua tìm kiếm cơ sở dữ liệu đã được tải xuống và các bản ghi trùng lặp đã bị xóa. Tiêu đề và tóm tắt của các hồ sơ còn lại đã được sàng lọc về mức độ liên quan đến bệnh gan và những người tham gia. Sau sàng lọc ban đầu này, danh sách các nghiên cứu được chọn đã được kiểm tra chéo để giải quyết sự khác biệt. Sau đó, các bài báo đầy đủ đã được lấy ra để đánh giá chi tiết.
Tiêu chí đủ điều kiện như sau: (a) các ấn phẩm là nghiên cứu lâm sàng, bao gồm các thử nghiệm đối chứng ngẫu nhiên, thử nghiệm đối chứng phi ngẫu nhiên trong tương lai và nghiên cứu đối chứng trường hợp; (b) những người tham gia được chẩn đoán mắc ACLF liên quan đến nhiễm HBV; (c) những người tham gia đã được cấy ghép MSC; (d) ngôn ngữ xuất bản không bị giới hạn; (e) các nguồn thu nhận MSC không bị hạn chế, và lộ trình cấy ghép MSC không bị hạn chế; và (f) nếu dữ liệu chồng chéo hoặc trùng lặp giữa hai hoặc nhiều nghiên cứu của cùng một nhóm nghiên cứu, thì chỉ nghiên cứu có dữ liệu đầy đủ hơn hoặc một nghiên cứu trước đó mới được đưa vào.
Lựa chọn nghiên cứu và khai thác dữ liệu
Hai người đánh giá (B.C. và J.Q.Q.) đã làm việc độc lập để xác định xem một nghiên cứu có đáp ứng các tiêu chí thu nhận để đánh giá giá trị phương pháp luận của từng nghiên cứu ứng cử viên hay không và trích xuất dữ liệu từ những nghiên cứu được đưa vào đó. Những người đánh giá đã giải quyết sự khác biệt bằng cách thảo luận. Nếu không đạt được sự đồng thuận, người đánh giá thứ ba (Y.H.W.), không biết về các quyết định trước đó, sẽ hoạt động như một trọng tài.
Các mục chính sau đây đã được trích xuất: tác giả đầu tiên, năm xuất bản, quốc gia, thiết kế nghiên cứu, nguồn MSC, số lượng MSC, lộ trình cấy ghép MSC, thời gian theo dõi, dữ liệu nhân khẩu học (tuổi và giới tính), dữ liệu phòng thí nghiệm trước và sau liệu pháp tế bào gốc [e.g. nồng độ albumin (ALB), bilirubin toàn phần (TBIL), thời gian prothrombin, alanine aminotransferase (ALT), HBV DNA, aspartate amino transferase, creatinine huyết thanh và α-fetoprotein huyết thanh, mô hình cho điểm bệnh gan giai đoạn cuối (MELD), Điểm số Child–Pugh], các biến cố bất lợi và khả năng sống sót.
Đánh giá chất lượng
Thang đo Newcastle–Ottawa được sử dụng để đánh giá chất lượng của các nghiên cứu phi ngẫu nhiên, đo lường chất lượng trong ba lĩnh vực, bao gồm lựa chọn, khả năng so sánh và mức độ tiếp xúc. Các nghiên cứu chất lượng cao được coi là có điểm từ bảy trở lên. Công cụ Sai số Rủi ro Cochrane được sử dụng để đánh giá chất lượng của các thử nghiệm ngẫu nhiên có đối chứng. Chất lượng nghiên cứu được đánh giá độc lập bởi hai nhà điều tra (B.C. và J.Q.Q.) và bất kỳ sự khác biệt nào đều được giải quyết bằng một cuộc thảo luận chung về bài báo gốc.
Phân tích thống kê
Kết quả chính của nghiên cứu này là tỷ lệ tử vong sau 12 tuần và ở lần theo dõi cuối cùng. Dữ liệu liên tục, bao gồm các mức điểm MELD, ALT, ALB và TBIL, được đánh giá bằng chênh lệch trung bình chuẩn hóa (SMD) với khoảng tin cậy (CI) 95%. Sau đó, SMD của từng nghiên cứu được kết hợp để tạo ra một SMD gộp. Dữ liệu phân đôi, bao gồm tử vong và các biến cố bất lợi được đánh giá bằng tỷ lệ rủi ro (RR) với KTC 95%. RR của từng nghiên cứu sau đó được kết hợp để tạo ra RR gộp. Giá trị P nhỏ hơn 0,05 được coi là có ý nghĩa thống kê đối với kích thước hiệu ứng. Tính không đồng nhất giữa các nghiên cứu được đánh giá bằng thống kê I2 (I2>50% cho thấy tính không đồng nhất đáng kể) và kiểm định χ 2 (P < 0,10 được coi là đại diện cho tính không đồng nhất có ý nghĩa thống kê). Tất cả các phân tích được thực hiện bằng gói thống kê Trình quản lý đánh giá phiên bản 5.3 (Trung tâm Cochrane Bắc Âu, Hợp tác Cochrane, Copenhagen, Đan Mạch).
Kết quả
Lựa chọn nghiên cứu và đặc điểm nghiên cứu
Nhìn chung, 753 bài báo đã được xác định từ ba cơ sở dữ liệu; sau khi sàng lọc tiêu đề và tóm tắt, 12 bài báo đã được đánh giá thêm. Tổng cộng có 9 bài báo đã bị loại vì những lý do khác như trong Hình 1. Cuối cùng, 3 bài báo đủ điều kiện để phân tích tổng hợp [13–15], bao gồm một thử nghiệm ngẫu nhiên có đối chứng [14], một nghiên cứu thuần tập không ngẫu nhiên triển vọng [15], và một đoàn hệ đối chứng trường hợp [13]. Tất cả 3 nghiên cứu đã được thực hiện ở Trung Quốc. Tổng cộng có 198 bệnh nhân ACLF đã được ghi danh cho tổng quan này; 91 bệnh nhân đã được điều trị bằng MSC và 107 bệnh nhân đã được điều trị bằng liệu pháp y tế tiêu chuẩn (SMT) dưới dạng đối chứng. Đặc điểm của từng nghiên cứu được thể hiện trong Bảng 1. Theo đánh giá về phương pháp luận, chỉ có thử nghiệm ngẫu nhiên đối chứng này được coi là có chất lượng cao và hai nghiên cứu còn lại được coi là có chất lượng thấp.
Năm 2012, Shi et al. [13] đã công bố kết quả của một nghiên cứu đối chứng trường hợp đánh giá tính an toàn và hiệu quả của việc truyền UC-MSC ở bệnh nhân ACLF liên quan đến nhiễm HBV. Không có tác dụng phụ đáng kể nào được quan sát thấy trong nhóm điều trị UC-MSC và điều trị UC-MSC làm giảm điểm số MELD. Nồng độ TBIL và ALT trong huyết thanh cũng giảm đáng kể sau khi điều trị bằng UC-MSC. Hơn nữa, nghiên cứu này cho thấy phương pháp điều trị UC-MSC làm tăng đáng kể tỷ lệ sống sót ở bệnh nhân ACLF. Những kết quả này gợi ý rằng các phương pháp điều trị UC-MSC có thể hỗ trợ sự phục hồi của bệnh nhân ACLF.
Vào năm 2016, một nghiên cứu tiến cứu khác đã được công bố bởi Li et al. [15] cũng đánh giá hiệu quả và độ an toàn của ghép UC MSC ở bệnh nhân HBV-ACLF được điều trị bằng trao đổi huyết tương và entecavir. Tổng cộng có 45 bệnh nhân HBV-ACLF liên tiếp được nghiên cứu tiền cứu. Người ta thấy rằng những bệnh nhân được ghép UC-MSC có tỷ lệ sống sót tích lũy cao hơn đáng kể sau 24 tháng (54,5 so với 26,5%, P = 0,015). Mức độ ALB, thời gian prothrombin và INR ở bệnh nhân ghép UC-MSC cũng được cải thiện rõ rệt sau 24 tháng (P <0,05). Ngoài ra, không có tác dụng phụ nghiêm trọng nào được quan sát thấy ở bất kỳ bệnh nhân nào.
Gần đây, kết quả của một thử nghiệm đối chứng ngẫu nhiên do một nhóm người Trung Quốc thực hiện đã được công bố. Tổng cộng có 110 bệnh nhân HBV-ACLF được ghi danh vào thử nghiệm ngẫu nhiên có đối chứng nhãn mở này. Nhóm đối chứng (n=54) chỉ được điều trị bằng SMT và nhóm thử nghiệm (n=56) được truyền hàng tuần trong 4 tuần với 1,0∼10×105 tế bào/kg MSC có nguồn gốc từ tủy xương đồng loài. Người ta thấy rằng những bệnh nhân được ghép MSC có tỷ lệ sống tích lũy cao hơn đáng kể ở tuần 24 (73,2 so với 55,6%, P=0,03). So với nhóm đối chứng, điều trị MSC có nguồn gốc từ tủy xương dị sinh đã cải thiện rõ rệt các phép đo trong phòng thí nghiệm lâm sàng, bao gồm cả TBIL và MELD huyết thanh. Đáng chú ý là tỷ lệ nhiễm trùng nặng ở nhóm MSC thấp hơn nhiều so với nhóm SMT (16,1 so với 33,3%, P=0,04).
Phân tích tổng hợp tỷ lệ tử vong
Tỷ lệ sống sót chung đã được báo cáo trong cả ba nghiên cứu bao gồm [13–15]. Tuy nhiên, thời gian theo dõi là khác nhau. Thời gian theo dõi là 24 tuần trong nghiên cứu của Lin, 24 tháng trong nghiên cứu của Li và 72 tuần trong nghiên cứu của Shi.
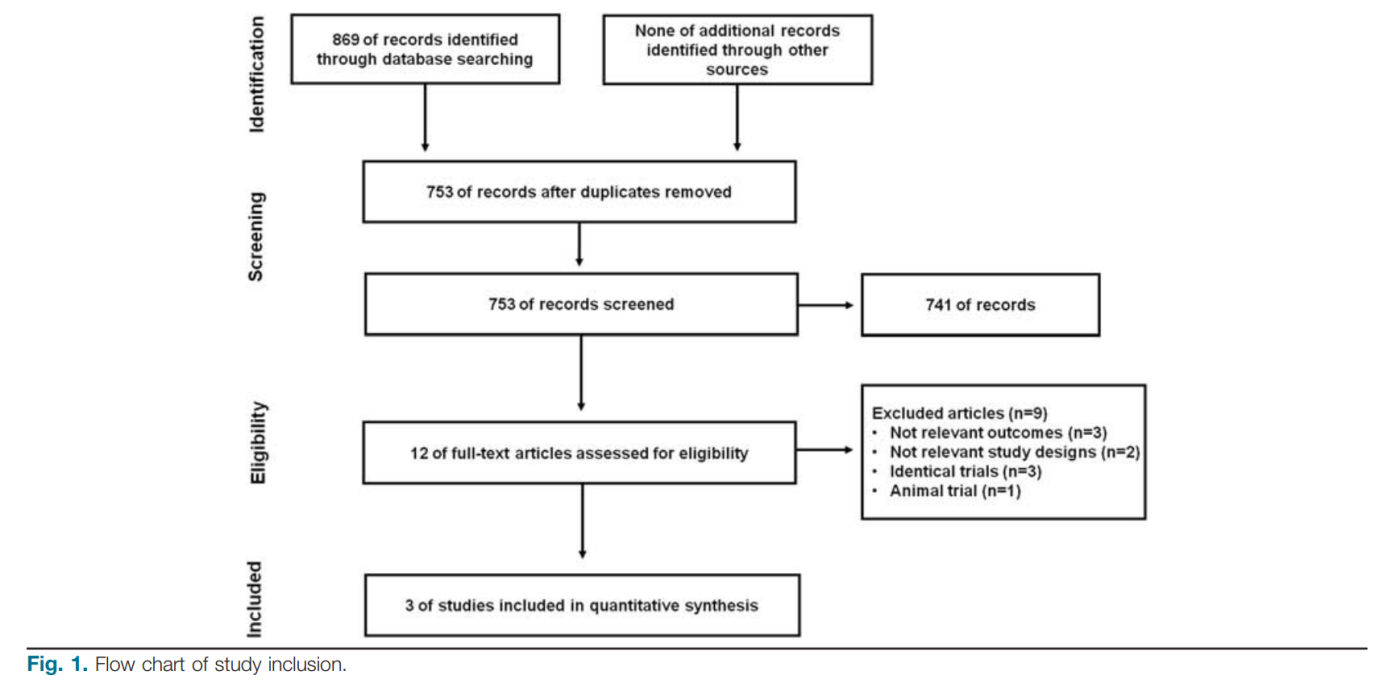
Trong nghiên cứu của Shi, 5 bệnh nhân (20,8%, 5/24) trong nhóm điều trị UC-MSC và 11 bệnh nhân (47,4%, 19/11) trong nhóm đối chứng đã chết trong 12 tuần đầu theo dõi. Trong nghiên cứu của Li, 29 bệnh nhân đã chết trong vòng 12 tuần sau khi điều trị, trong đó có 5 bệnh nhân (45,4%, 5/11) trong nhóm điều trị UC-MSC và 24 bệnh nhân (70,5%, 24/34) trong nhóm đối chứng. Vào tháng 24, 31 bệnh nhân đã chết. Trong số 31 trường hợp tử vong, 5 bệnh nhân (45,5%) thuộc nhóm điều trị UC-MSC và 26 bệnh nhân (76,5%, 26/34) thuộc nhóm đối chứng. Trong nghiên cứu của Lin, 32 bệnh nhân đã chết trong vòng 12 tuần sau khi điều trị, 11 (19,6%, 11/56) trong nhóm điều trị bằng MSC và 21 (38,3%, 21/54) trong nhóm đối chứng. Vào tuần 24, 39 bệnh nhân tử vong, bao gồm 15 (26,7%, 15/56) ở nhóm điều trị MSC và 24 (48,6%, 24/54) ở nhóm chứng.
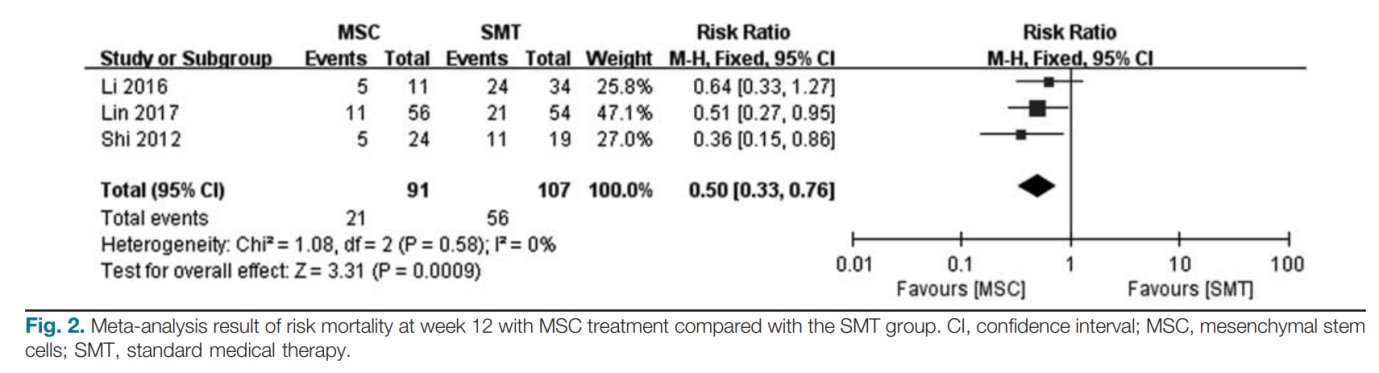
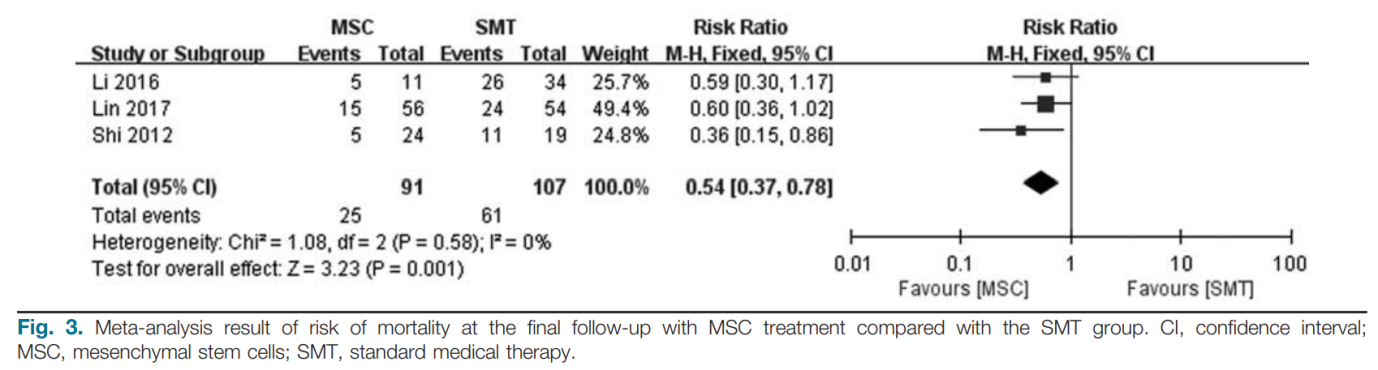
Tỷ lệ tử vong ở tuần thứ 12 sau khi điều trị được thu thập từ cả ba nghiên cứu được thu nhận. Tổng cộng, 21 bệnh nhân (23,1%, 21/91) tử vong ở tuần thứ 12 trong nhóm MSC và 56 bệnh nhân (52,3%, 56/107) tử vong trong nhóm chứng. Kết quả tổng hợp cho thấy điều trị bằng MSC có thể làm giảm đáng kể tỷ lệ tử vong ở tuần thứ 12 (RR: 0,50; KTC 95%: 0,33, 0,76; P= 0,00009; Hình 2) so với SMT. Không có sự không đồng nhất đáng kể nào được phát hiện giữa các nghiên cứu (Q = 0,58; I2 = 0%). Hơn nữa, tỷ lệ tử vong ở lần theo dõi cuối cùng sau khi điều trị được rút ra từ cả ba nghiên cứu được đưa vào. Tổng cộng, 25 bệnh nhân (27,5%, 25/91) tử vong sau 12 tuần ở nhóm MSC và 61 bệnh nhân (57%, 61/107) tử vong ở nhóm chứng. Kết quả tổng hợp cho thấy rằng điều trị bằng MSC cũng có thể làm giảm đáng kể tỷ lệ tử vong ở lần theo dõi cuối cùng (RR: 0,54; KTC 95%: 0,37, 0,78; P= 0,001; Hình 3) so với nhóm SMT. Không có sự không đồng nhất đáng kể nào được phát hiện giữa các nghiên cứu (Q = 0,58; I2 = 0%).
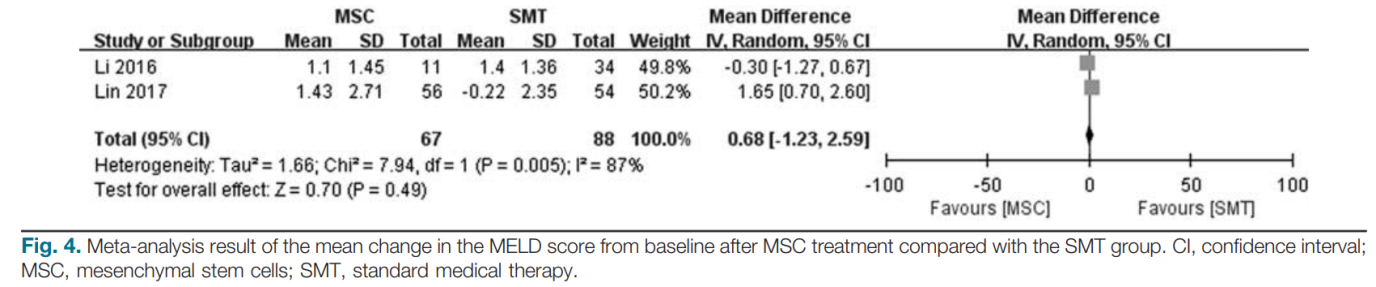
Phân tích tổng hợp mô hình thay đổi điểm bệnh gan giai đoạn cuối sau 2 tuần điều trị
Hai nghiên cứu đã báo cáo những thay đổi về điểm số MELD so với ban đầu [14,15]. Nghiên cứu của Lin cho thấy điểm MELD ở nhóm MSC đã giảm đáng kể so với nhóm SMT ở tuần thứ 2. Tuy nhiên, việc điều trị bằng MSC không làm giảm đáng kể điểm MELD ở tuần thứ 2 so với nhóm SMT trong nghiên cứu của Li. Ước tính tổng hợp cho thấy điều trị bằng MSC không làm giảm đáng kể điểm số MELD ở tuần thứ 2 đối với bệnh nhân ACLF (MD: 0,68; KTC 95%: – 1,23, 2,59; P=0,49; Hình 4) so với nhóm SMT. Sự không đồng nhất đáng kể đã được phát hiện giữa các nghiên cứu (Q = 0,005; I2 = 87%). Do đó, một mô hình hiệu ứng ngẫu nhiên đã được áp dụng cho phân tích tổng hợp.
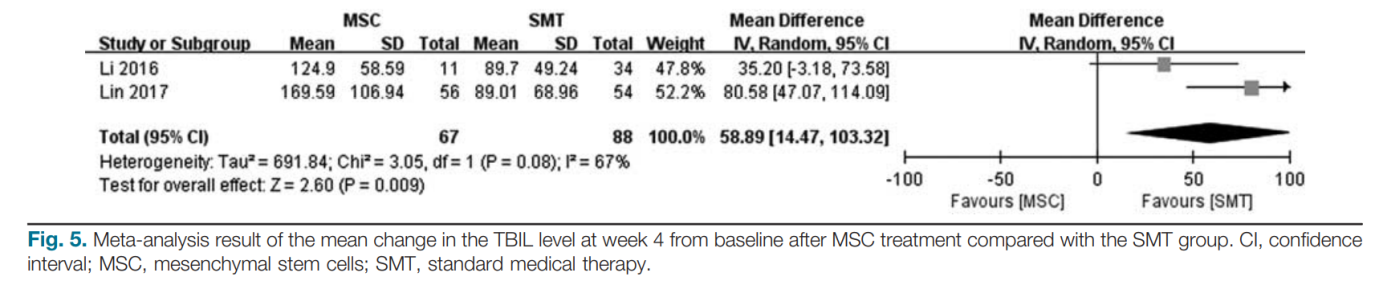
Phân tích tổng hợp các thay đổi về kết quả chức năng gan sau điều trị
Hai nghiên cứu đã báo cáo những thay đổi về ALT, TBIL, ALB và INR [14,15]. Ước tính tổng hợp cho thấy điều trị bằng MSC không làm giảm ALT nhiều hơn (MD: 29,99; KTC 95%: − 89,61, 149,59; P=0,62), TBIL (MD: 39,28; KTC 95%: − 61,76, 140,32; P=0,45), ALB (MD: 0,06; KTC 95%: − 1,00, 1,11; P=0,92) và INR (MD: 0,01; KTC 95%: − 0,08, 0,1; P=0,84) ở tuần thứ 2 đối với bệnh nhân ACLF so với nhóm SMT. Tuy nhiên, các ước tính tổng hợp cho thấy rằng điều trị bằng MSC có thể làm giảm đáng kể giá trị của TBIL ở tuần thứ 4 (MD: 58,89; KTC 95%: 14,47, 103,32; P=0,009; Hình 5) so với nhóm SMT. Một mô hình hiệu ứng ngẫu nhiên đã được áp dụng cho các phân tích tổng hợp này.
Tác dụng phụ liên quan đến điều trị tế bào gốc trung mô
Trong nghiên cứu của Shi [13], hai bệnh nhân bị sốt tự giới hạn (nhiệt độ cơ thể: 37–38°C) trong vòng 2–6 giờ sau khi truyền UC-MSC, nhưng đã hồi phục trong vòng 12 giờ mà không cần điều trị thêm. Trong nhóm đối chứng, không có bệnh nhân nào bị sốt. Không có biến chứng hoặc tác dụng phụ nào được tìm thấy ở những bệnh nhân được điều trị bằng UC-MSC trong thời gian theo dõi. Ngoài ra, không có tác dụng phụ hoặc biến chứng nghiêm trọng nào (bao gồm đau gan, xuất huyết, sốt, v.v.) được quan sát thấy sau thủ thuật trong nghiên cứu của Li [15]. Nghiên cứu của Lin quan sát thấy rằng tỷ lệ nhiễm trùng ở nhóm MSC thấp hơn nhiều so với nhóm SMT (25,0 so với 44,4%; P=0,03) [14], nhưng không có sự khác biệt nào được ghi nhận về tỷ lệ mắc các biến chứng nghiêm trọng khác (ví dụ: bệnh não, hội chứng gan thận, xuất huyết tiêu hóa) giữa nhóm SMT và MSC.
Thảo luận
Đánh giá hệ thống và phân tích tổng hợp hiện tại của chúng tôi nhằm đánh giá hồ sơ hiệu quả và an toàn của việc điều trị MSC ở những bệnh nhân mắc ACLF liên quan đến nhiễm HBV. Kết quả cho thấy điều trị bằng MSC có thể làm giảm đáng kể tỷ lệ tử vong mà không làm tăng tỷ lệ biến chứng nặng. Tuy nhiên, có tranh cãi về lợi ích của việc điều trị MSC trong việc cải thiện chức năng gan và điểm số MELD.
Đối với một liệu pháp mới, hồ sơ an toàn được các bác sĩ lâm sàng và bệnh nhân quan tâm rộng rãi. Ba nghiên cứu đã báo cáo kết quả này và không có nghiên cứu nào quan sát thấy các tác dụng phụ nghiêm trọng liên quan đến việc truyền MSC ở bệnh nhân mắc ACLF so với nhóm SMT. Tuy nhiên, tỷ lệ sốt ở nhóm MSC cao hơn đáng kể so với nhóm SMT. Đáng chú ý là cơn sốt hạn chế, không cần can thiệp y tế. Do đó, bằng chứng hiện tại cho thấy rằng điều trị bằng MSC là an toàn cho bệnh nhân nhiễm HBV-ACLF.
Một câu hỏi quan trọng khác là tác động của điều trị MSC đối với sự sống còn của bệnh nhân nhiễm HBV-ACLF. Đối với bệnh nhân ACLF, điều quan trọng là xác định liệu bệnh nhân có thể sống sót trong 3 tháng đầu hay không. Kjaergard et al. [16] đã báo cáo tỷ lệ tử vong là 51% trong phân tích tổng hợp hệ thống của họ. Tỷ lệ tử vong ngắn hạn có thể lên tới 65% vào tháng thứ 3. Rõ ràng, điều trị MSC có thể giúp bệnh nhân ACLF sống sót sau 3 tháng đầu tiên của bệnh. Kết quả tổng hợp của chúng tôi cho thấy rằng điều trị bằng MSC có thể làm giảm đáng kể tỷ lệ tử vong ở tuần thứ 12 và ở lần theo dõi cuối cùng. Ngoài ra, theo kết quả của Lin, lợi ích này có thể liên quan đến việc giảm tỷ lệ nhiễm trùng nặng ở nhóm MSC so với nhóm SMT (16,1 so với 33,3%, P=0,04). Hơn nữa, tỷ lệ tử vong do suy đa cơ quan và nhiễm trùng nặng ở nhóm SMT cao hơn so với nhóm MSC (37,0 so với 17,9%; P= 0,02). Mất cân bằng miễn dịch và viêm hệ thống đóng vai trò quan trọng trong sự phát triển của suy gan. Kết quả của Lin cho thấy rằng điều trị MSC có thể phục vụ các chức năng điều hòa miễn dịch và chống viêm, có thể làm giảm viêm gan, cải thiện chức năng gan, giảm tỷ lệ nhiễm trùng nặng và do đó cải thiện tỷ lệ sống sót. Nghiên cứu của Shi cho thấy mức độ α-fetoprotein tăng từ 14 ng/ml ở mức cơ bản lên 7170 ng/ml ở tuần thứ 1 sau lần điều trị UC-MSC đầu tiên và nó duy trì ở mức cao trong 8 tuần tiếp theo sau đó, điều mà không được quan sát thấy trong nhóm đối chứng. Điều này có nghĩa là việc truyền UC-MSC có thể thúc đẩy quá trình tăng sinh tế bào gan và do đó giúp bệnh nhân hồi phục sau ACLF, đặc biệt là trong 3 tháng đầu tiên.
Tác dụng của điều trị MSC đối với chức năng gan và điểm số MELD đang gây tranh cãi. Mặc dù điều trị MSC Bảng 1. có thể cải thiện đáng kể chức năng gan và điểm số MELD so với ban đầu trong nhóm MSC, kết quả tổng hợp của chúng tôi cho thấy rằng điều trị MSC không thể cải thiện rõ rệt điểm số MELD, ALT, ALB và INR so với nhóm đối chứng.
Một vấn đề khác là phác đồ điều trị MSC, bao gồm tần suất điều trị MSC, lộ trình điều trị MSC, nguồn MSC và số lượng tế bào MSC. Trong nghiên cứu của Shi, liệu pháp UC-MSC được thực hiện ba lần trong khoảng thời gian 4 tuần với ~ 0,5 × 106 tế bào/kg trọng lượng cơ thể, một lần cấy ghép UC-MSC được thực hiện với khoảng 100 × 106 tế bào thông qua động mạch gan thích hợp trong nghiên cứu của Li, và MSC có nguồn gốc từ tủy xương đồng loài được truyền hàng tuần trong 4 tuần với 1,0–10 × 105 tế bào/kg. Điều này gợi ý rằng điều trị bằng MSC có hiệu quả thông qua cả đường tĩnh mạch và động mạch gan. Các thử nghiệm trong tương lai có thể đánh giá hiệu quả tương đối của các lộ trình khác nhau, khám phá số lượng tế bào gốc tối ưu và đánh giá tần suất điều trị MSC tối ưu.
Sức mạnh của đánh giá hệ thống và phân tích tổng hợp hiện tại của chúng tôi bị hạn chế bởi số lượng và chất lượng của các nghiên cứu được đưa vào. Chỉ có một RCT được đưa vào và hai nghiên cứu còn lại là các thử nghiệm đối chứng không ngẫu nhiên, điều này có thể làm tăng độ sai lệch trong nghiên cứu.
Hơn nữa, cỡ mẫu của nghiên cứu tương đối nhỏ, đặc biệt là đối với hai nghiên cứu đối chứng phi ngẫu nhiên này. Một hạn chế khác là tất cả các nghiên cứu đều được thực hiện ở Trung Quốc và không có dữ liệu liên quan nào được công bố bởi các nhà nghiên cứu từ các quốc gia khác. Do đó, kết luận từ đánh giá của chúng tôi không thể được khái quát hóa cho các quốc gia khác. Ngoài ra, không thể tránh được sai lệch xuất bản do số lượng nghiên cứu được đưa vào. Sẽ cần nhiều thử nghiệm hơn với các mẫu lớn hơn và thiết kế tốt trong tương lai để đánh giá thêm hiệu quả của điều trị MSC trong việc quản lý bệnh nhân ACLF liên quan đến HBV.
Nhìn chung, kết quả tổng hợp của chúng tôi cho thấy rằng điều trị bằng MSC có thể làm giảm đáng kể tỷ lệ tử vong đối với bệnh nhân HBV-ACLF ở Trung Quốc so với SMT. Ngoài ra, không có tác dụng phụ nghiêm trọng nào xảy ra, ngoại trừ tỷ lệ sốt tăng lên mà không cần can thiệp y tế. Nói chung, phương pháp điều trị MSC thuận tiện, an toàn và hiệu quả trong việc quản lý bệnh nhân HBV-ACLF.
Nguồn: Wolters Kluwer Health, Inc






